Actos til type 2-diabetes
Mærkenavn: Actos
Generisk navn: Pioglitazone hydrochloride
Indhold:
Beskrivelse
Farmakologi
Indikationer og anvendelse
Kontraindikationer
Advarsler
Forholdsregler
Bivirkninger
Overdosis
Dosering og administration
Hvordan leveres
Actos, pioglitazone hcl, patientinformation (på almindeligt engelsk)
ADVARSEL: KONGESTIVT HJERTEFEL
- Thiazolidinediones, inklusive Actos, forårsager eller forværrer kongestiv hjertesvigt hos nogle patienter (se ADVARSLER). Efter initiering af Actos, og efter stigning i dosis, skal patienterne følges omhyggeligt for tegn og symptomer på hjertesvigt (inklusive overdreven, hurtig vægtøgning, dyspnø og / eller ødemer). Hvis disse tegn og symptomer udvikler sig, skal hjertesvigt håndteres i henhold til de gældende plejestandarder. Desuden skal seponering eller dosisreduktion af Actos overvejes.
- Actos anbefales ikke til patienter med symptomatisk hjertesvigt. Initiering af Actos hos patienter med etableret NYHA klasse III eller IV hjertesvigt er kontraindiceret (se KONTRAINDIKATIONER og ADVARSLER).
Beskrivelse
Actos (pioglitazonhydrochlorid) er et oralt antidiabetisk middel, der primært virker ved at nedsætte insulinresistensen. Actos bruges til behandling af type 2-diabetes mellitus (også kendt som ikke-insulinafhængig diabetes mellitus [NIDDM] eller voksen-debut diabetes). Farmakologiske undersøgelser viser, at Actos forbedrer følsomheden over for insulin i muskel- og fedtvæv og hæmmer glukoneogenese i leveren. Actos forbedrer den glykæmiske kontrol, mens den reducerer cirkulerende insulinniveauer.
Pioglitazon [(±) -5 - [[4- [2- (5-ethyl-2-pyridinyl) ethoxy] phenyl] methyl] -2,4-] thiazolidinedionmonohydrochlorid hører til en anden kemisk klasse og har en anden farmakologisk virkning end sulfonylurinstofferne, metformin eller Î ± -glucosidasen inhibitorer. Molekylet indeholder et asymmetrisk carbon, og forbindelsen syntetiseres og anvendes som den racemiske blanding. De to enantiomerer af pioglitazon interkonverterer in vivo. Der blev ikke fundet nogen forskelle i den farmakologiske aktivitet mellem de to enantiomerer. Strukturformlen er som vist:
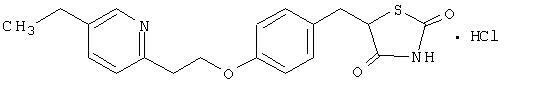
Pioglitazon-hydrochlorid er et lugtfrit hvidt krystallinsk pulver, der har en molekylformel af C19H20N2O3S-HCI og en molekylvægt på 392,90 dalton. Det er opløseligt i N, N-dimethylformamid, let opløselig i vandfri ethanol, meget let opløselig i acetone og acetonitril, praktisk talt uopløselig i vand og uopløselig i ether.
Actos fås som en tablet til oral indgivelse indeholdende 15 mg, 30 mg eller 45 mg pioglitazon (som base) formuleret med følgende hjælpestoffer: lActose monohydrat NF, hydroxypropylcellulose NF, carboxymethylcellulose calcium NF og magnesiumstearat NF.
top
Klinisk farmakologi
Handlingsmekanisme
Actos er et antidiabetisk middel mod thiazolidinedione, der afhænger af tilstedeværelsen af insulin for dets virkningsmekanisme. Actos nedsætter insulinresistensen i periferien og i leveren, hvilket resulterer i øget insulinafhængig glucosebortskaffelse og nedsat lever glukoseudbytte. I modsætning til sulfonylurinstoffer er pioglitazon ikke en insulinsekretagoge. Pioglitazon er en potent agonist til peroxisomproliferator-aktiveret receptor-gamma (PPARγ). PPAR-receptorer findes i væv, der er vigtige til insulinvirkning, såsom fedtvæv, knoglemuskler og lever. Aktivering af PPARγ-nukleare receptorer modulerer transkriptionen af et antal insulinresponsive gener involveret i kontrollen af glukose og lipidmetabolisme.
I dyremodeller af diabetes reducerer pioglitazon hyperglykæmi, hyperinsulinæmi og hypertriglyceridæmi, der er karakteristisk for insulinresistente tilstande, såsom type 2-diabetes. De metaboliske ændringer, der er produceret af pioglitazon, resulterer i øget reaktionsevne af insulinafhængigt væv og observeres i adskillige dyremodeller af insulinresistens.
Da pioglitazon forbedrer virkningen af cirkulerende insulin (ved at nedsætte insulinresistensen), sænker det ikke blodsukkeret i dyremodeller, der mangler endogent insulin.
Farmakokinetik og stofmetabolisme
Serumkoncentrationer af total pioglitazon (pioglitazon plus aktive metabolitter) forbliver forhøjede 24 timer efter dosering en gang dagligt. Serumkoncentrationer ved stabil tilstand af både pioglitazon og total pioglitazon opnås inden for 7 dage. Ved stabil tilstand når to af de farmakologisk aktive metabolitter af pioglitazon, Metabolites III (M-III) og IV (M-IV), serumkoncentrationer, der er lig med eller større end pioglitazon. Både sunde frivillige og hos patienter med type 2-diabetes udgør pioglitazon ca. 30% til 50% af maksimale totale pioglitazon-serumkoncentrationer og 20% til 25% af det samlede areal under serumkoncentration-tidskurven (AUC).
Maksimal serumkoncentration (Cmax), AUC og gennemgang af serumkoncentrationer (Cmin) for både pioglitazon og total pioglitazon stiger proportionalt i doser på 15 mg og 30 mg pr. dag. Der er en lidt mindre end proportional stigning for pioglitazon og total pioglitazon i en dosis på 60 mg pr. Dag.
Absorption: Efter oral administration, i fastende tilstand, kan pioglitazon først måles i serum inden for 30 minutter, med maksimale koncentrationer observeret inden for 2 timer. Fødevarer forsinker lidt tid til at maksimere serumkoncentrationen til 3 til 4 timer, men ændrer ikke absorptionsomfanget.
Distribution: Det gennemsnitlige tilsyneladende distributionsvolumen (Vd / F) af pioglitazon efter administration af enkeltdosis er 0,63 ± 0,41 (gennemsnit ± SD) L / kg kropsvægt.
Pioglitazon er i vid udstrækning proteinbundet (> 99%) i humant serum, hovedsageligt til serumalbumin. Pioglitazon binder også til andre serumproteiner, men med lavere affinitet. Metabolitter M-III og M-IV er også i vid udstrækning bundet (> 98%) til serumalbumin.
Metabolisme: Pioglitazon metaboliseres i vid udstrækning ved hydroxylering og oxidation; metabolitterne omdannes også delvis til glucuronid- eller sulfatkonjugater. Metabolitter M-II og M-IV (hydroxyderivater af pioglitazon) og M-III (keto-derivat af pioglitazon) er farmakologisk aktive i dyremodeller af type 2-diabetes. Foruden pioglitazon er M-III og M-IV de vigtigste lægemiddelrelaterede arter, der findes i humant serum efter multiple doseringer. Ved steady-state, både raske frivillige og hos patienter med type 2-diabetes, pioglitazon omfatter ca. 30% til 50% af de samlede maksimale serumkoncentrationer og 20% til 25% af samlet AUC.
In vitro-data viser, at flere CYP-isoformer er involveret i metabolismen af pioglitazon. De involverede cytochrome P450-isoformer er CYP2C8 og i mindre grad CYP3A4 med yderligere bidrag fra en række andre isoformer inklusive den hovedsageligt ekstrahepatiske CYP1A1. In vivo-undersøgelser af pioglitazon i kombination med P450-hæmmere og substrater er blevet udført (se Lægemiddelinteraktioner). Urinære 6Ÿ-hydroxycortisol / cortisol-forhold målt hos patienter behandlet med Actos viste, at pioglitazon ikke er en stærk CYP3A4-enzyminducer.
Udskillelse og eliminering: Efter oral administration genvindes ca. 15% til 30% af pioglitazondosen i urinen. Eliminering af pioglitazon er ubetydelig, og lægemidlet udskilles primært som metabolitter og deres konjugater. Det antages, at det meste af den orale dosis udskilles i galden enten uændret eller som metabolitter og elimineres i fæces.
Den gennemsnitlige serumhalveringstid for pioglitazon og total pioglitazon varierer fra henholdsvis 3 til 7 timer og 16 til 24 timer. Pioglitazon har en tilsyneladende clearance, CL / F, beregnet til at være 5 til 7 l / time.
Særlige befolkninger
Nedsat nyrefunktion: Halveringstiden for serumeliminering af pioglitazon, M-III og M-IV forbliver uændret hos patienter med moderat (kreatininclearance 30 til 60 ml / min) til svær (kreatininclearance <30 ml / min) nedsat nyrefunktion sammenlignet med normalt emner. Ingen dosisjustering anbefales til patienter med nedsat nyrefunktion (se DOSERING OG ADMINISTRATION).
Nedsat leverfunktion: Sammenlignet med normale kontroller har personer med nedsat leverfunktion (Child-Pugh Grade B / C) en ca. 45% reduktion i pioglitazon og total pioglitazon gennemsnitlige topkoncentrationer, men ingen ændring i det gennemsnitlige AUC værdier.
Actos-behandling bør ikke påbegyndes, hvis patienten udviser klinisk bevis for aktiv leversygdom eller serumtransaminase niveauer (ALT) overstiger 2,5 gange den øvre normalgrænse (se FORHOLDSREGLER, Levereffekter).
Ældre: Hos raske ældre individer er maksimale serumkoncentrationer af pioglitazon og total pioglitazon ikke signifikant forskellige, men AUC-værdier er lidt højere og de terminale halveringstider værdier lidt længere end for yngre fag. Disse ændringer var ikke af en størrelse, der ville blive betragtet som klinisk relevante.
Pædiatri: Farmakokinetiske data for den pædiatriske population er ikke tilgængelige.
Køn: Den gennemsnitlige Cmax og AUC-værdier blev forøget 20% til 60% hos kvinder. Som monoterapi og i kombination med sulfonylurinstof, metformin eller insulin forbedrede Actos den glykæmiske kontrol hos både mænd og kvinder. I kontrollerede kliniske forsøg, hæmoglobin A1c (HbA1c) Fald fra baseline var generelt større for kvinder end for mænd (gennemsnitlig gennemsnitlig forskel i HbA1c 0.5%). Da behandling bør individualiseres for hver patient for at opnå glykæmisk kontrol, anbefales ingen dosisjustering baseret på køn alene.
Etnicitet: Farmakokinetiske data blandt forskellige etniske grupper er ikke tilgængelige.
Drug-Drug Interactions
De følgende lægemidler blev undersøgt hos raske frivillige med en samtidig administration af Actos 45 mg en gang dagligt. Nedenfor vises resultaterne:
Orale præceptionsmidler: Samtidig indgivelse af Actos (45 mg en gang dagligt) og et oralt prævention (1 mg norethindrone plus 0,035 mg ethinyløstradiol en gang dagligt) i 21 dage, resulterede i 11% og 11-14% fald i ethinyløstradiol AUC (0-24 timer) og Cmax henholdsvis. Der var ingen signifikante ændringer i norethindrone AUC (0-24 timer) og Cmax. I betragtning af den høje variation i farmakokinetikken for ethinyløstradiol er den kliniske betydning af dette fund ukendt.
Fexofenadin HCl: Samtidig administration af Actos i 7 dage med 60 mg fexofenadin indgivet oralt to gange dagligt resulterede ikke i nogen signifikant effekt på farmakokinetikken for pioglitazon. Actos havde ingen signifikant effekt på fexofenadin farmakokinetik.
Glipizid: Samtidig indgivelse af Actos og 5 mg glipizid, der blev indgivet oralt en gang dagligt i 7 dage, ændrede ikke farmakokinetikken for glipizid ved stabil tilstand.
Digoxin: Samtidig administration af Actos med 0,25 mg digoxin indgivet oralt en gang dagligt i 7 dage ændrede ikke farmakokinetikken for digoxin ved stabil tilstand.
Warfarin: Samtidig administration af Actos i 7 dage med warfarin ændrede ikke farmakokinetikken for warfarin ved stabil tilstand. Actos har ingen klinisk signifikant effekt på protrombintid, når det administreres til patienter, der får kronisk warfarinbehandling.
Metformin: Samtidig administration af en enkelt dosis metformin (1000 mg) og Actos efter 7 dages Actos ændrede ikke farmakokinetikken for den enkelte dosis metformin.
Midazolam: Administration af Actos i 15 dage efterfulgt af en enkelt 7,5 mg dosis af midazolam sirup resulterede i en reduktion på 26% i midazolam Cmax og AUC.
Ranitidin HCI: Samtidig administration af Actos i 7 dage med ranitidin indgivet oralt to gange dagligt i enten 4 eller 7 dage resulterede ikke i nogen signifikant effekt på farmakokinetikken for pioglitazon. Actos viste ingen signifikant effekt på ranitidins farmakokinetik.
Nifedipin ER: Samtidig administration af Actos i 7 dage med 30 mg nifedipin ER administreret oralt en gang dagligt i 4 dage til mandlige og kvindelige frivillige resulterede i mindst kvadratiske gennemsnit (90% CI) -værdier for uændret nifedipin på 0,83 (0,73 - 0,95) for Cmax og 0,88 (0,80 - 0,96) for AUC. I betragtning af den høje variation i nifedipin farmakokinetik er den kliniske betydning af dette fund ukendt.
Ketoconazol: Samtidig administration af Actos i 7 dage med ketoconazol 200 mg administreret to gange dagligt resulterede i mindst kvadratiske middelværdier (90% CI) -værdier for uændret pioglitazon på 1,14 (1,06 - 1,23) for Cmax1,34 (1,26 - 1,41) for AUC og 1,87 (1,71 - 2,04) for Cmin.
Atorvastatin Calcium: Samtidig administration af Actos i 7 dage med atorvastatin calcium (LIPITOR®) 80 mg en gang dagligt resulterede i mindst kvadratiske gennemsnit (90% CI) -værdier for uændret pioglitazon på 0,69 (0,57 - 0,85) for Cmax0,76 (0,65 - 0,88) for AUC og 0,96 (0,87 - 1,05) for Cmin. For uændret atorvastatin var de mindst kvadratiske middelværdier (90% Cl) værdier 0,77 (0,66 - 0,90) for Cmax0,86 (0,78 - 0,94) for AUC og 0,92 (0,82 - 1,02) for Cmin.
Theophylline: Samtidig indgivelse af Actos i 7 dage med theophylline 400 mg administreret to gange dagligt resulterede i ingen ændring i farmakokinetikken for et hvilket som helst lægemiddel.
Cytochrome P450: Se FORHOLDSREGLER
Gemfibrozil: Samtidig administration af gemfibrozil (oral 600 mg to gange dagligt), en hæmmer af CYP2C8, med pioglitazon (oral 30 mg) hos 10 raske frivillige forbehandlede i 2 dage før med gemfibrozil (oral 600 mg to gange dagligt) resulterede det i pioglitazoneksponering (AUC0-24), der udgjorde 226% af eksponeringen for pioglitazon i fravær af gemfibrozil (se FORHOLDSREGLER).
Rifampin: Samtidig administration af rifampin (oral 600 mg en gang dagligt), en inducer af CYP2C8 og pioglitazon (oral 30 mg) hos 10 sunde frivillige, der var forbehandlet i 5 dage før med rifampin (oralt 600 mg en gang dagligt) resulterede i et fald i AUC for pioglitazon med 54% (se FORHOLDSREGLER).
Farmakodynamik og kliniske effekter
Kliniske studier viser, at Actos forbedrer insulinfølsomheden hos insulinresistente patienter. Actos forbedrer cellulær modtagelighed over for insulin, øger insulinafhængig glucosebortskaffelse, forbedrer leverfølsomheden over for insulin og forbedrer dysfunktionel glukosehomeostase. Hos patienter med type 2-diabetes resulterer den nedsatte insulinresistens produceret af Actos i lavere plasmaglukosekoncentrationer, lavere plasmainsulinniveauer og lavere HbA1c værdier. Baseret på resultater fra en open-label-forlængelsesundersøgelse ser det ud til, at de glukosesænkende virkninger af Actos fortsætter i mindst et år. I kontrollerede kliniske forsøg havde Actos i kombination med sulfonylurinstof, metformin eller insulin en additiv virkning på glykæmisk kontrol.
Patienter med lipid abnormaliteter blev inkluderet i kliniske forsøg med Actos. Generelt havde patienter behandlet med Actos gennemsnitlige fald i triglycerider, gennemsnitlige stigninger i HDL-kolesterol og ingen konsistente gennemsnitlige ændringer i LDL og totalcholesterol.
I en 26-ugers, placebokontrolleret, dosisvarende undersøgelse faldt de gennemsnitlige triglyceridniveauer i dosisgrupperne 15 mg, 30 mg og 45 mg Actos sammenlignet med en gennemsnitlig stigning i placebogruppen. Gennemsnitlige HDL-niveauer steg i højere grad hos patienter behandlet med Actos end hos de placebo-behandlede patienter. Der var ingen konsistente forskelle for LDL og totalcholesterol hos patienter behandlet med Actos sammenlignet med placebo (tabel 1).
Tabel 1 Lipider i en 26-ugers placebo-kontrolleret dosering i monoterapi
| Placebo | Actos 15 mg Enkelt gang Daglige |
Actos 30 mg Enkelt gang Daglige |
Actos 45 mg Enkelt gang Daglige |
|
| Triglycerider (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Baseline (gennemsnit) | 262.8 | 283.8 | 261.1 | 259.7 |
| Procentændring fra basislinje (gennemsnit) | 4.8% | -9.0% | -9.6% | -9.3% |
| HDL-kolesterol (mg / dL) | N = 79 | N = 79 | N = 83 | N = 77 |
| Baseline (gennemsnit) | 41.7 | 40.4 | 40.8 | 40.7 |
| Procentændring fra basislinje (gennemsnit) | 8.1% | 14.1% | 12.2% | 19.1% |
| LDL-kolesterol (mg / dL) | N = 65 | N = 63 | N = 74 | N = 62 |
| Baseline (gennemsnit) | 138.8 | 131.9 | 135.6 | 126.8 |
| Procentændring fra basislinje (gennemsnit) | 4.8% | 7.2% | 5.2% | 6.0% |
| Samlet kolesterol (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Baseline (gennemsnit) | 224.6 | 220.0 | 222.7 | 213.7 |
| Procentændring fra basislinje (gennemsnit) | 4.4% | 4.6% | 3.3% | 6.4% |
I de to andre monoterapistudier (24 uger og 16 uger) og i kombinationsbehandlingsundersøgelser med sulfonylurinstof (24 uger og 16 uger) og metformin (24 uger og 16 uger) var resultaterne generelt i overensstemmelse med dataene over. I placebokontrollerede forsøg faldt de placebokorrigerede gennemsnitlige ændringer fra baseline 5% til 26% for triglycerider og steg 6% til 13% for HDL hos patienter behandlet med Actos. Et lignende resultatmønster blev set i 24-ugers kombinationsbehandlingsundersøgelser af Actos med sulfonylurea eller metformin.
I en kombinationsterapiundersøgelse med insulin (16 uger) blev den placebokorrigerede gennemsnitlige procentvise ændring fra baseline i triglyceridværdier for patienter, der blev behandlet med Actos, også reduceret. En placebokorrigeret gennemsnitlig ændring fra baseline i LDL-kolesterol på 7% blev observeret for dosisgruppen på 15 mg. Lignende resultater som dem, der er nævnt ovenfor for HDL og totalcholesterol, blev observeret. Et lignende resultatmønster blev set i en 24-ugers kombinationsterapiundersøgelse med Actos med insulin.
Kliniske studier
monoterapi
I USA blev der gennemført tre randomiserede, dobbeltblinde, placebokontrollerede forsøg med varigheder fra 16 til 26 uger for at evaluere brugen af Actos som monoterapi hos patienter med type 2-diabetes. Disse studier undersøgte Actos i doser op til 45 mg eller placebo en gang dagligt hos 865 patienter.
I en 26-ugers dosisvarende undersøgelse blev 408 patienter med type 2-diabetes randomiseret til at modtage 7,5 mg, 15 mg, 30 mg eller 45 mg Actos eller placebo en gang dagligt. Behandling med ethvert tidligere antidiabetisk middel blev afbrudt 8 uger før den dobbeltblinde periode. Behandling med 15 mg, 30 mg og 45 mg Actos frembragte statistisk signifikante forbedringer i HbA1c og fastende plasmaglukose (FPG) ved slutpunkt sammenlignet med placebo (figur 1, tabel 2).
Figur 1 viser tidsforløbet for ændringer i FPG og HbA1c for hele studiepopulationen i denne 26-ugers undersøgelse.
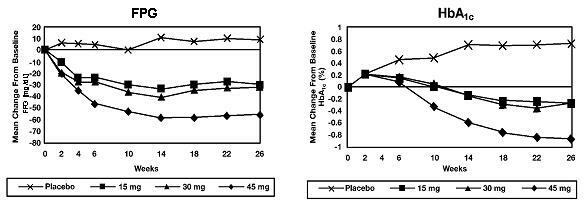
Tabel 2 viser HbA1c og FPG-værdier for hele undersøgelsespopulationen.
Tabel 2 Glykæmiske parametre i en 26-ugers placebokontrolleret doserangerende undersøgelse
| Placebo | Actos 15 mg Enkelt gang Daglige |
Actos 30 mg Enkelt gang Daglige |
Actos 45 mg Enkelt gang Daglige |
|
| TOTAL BEVOLKNING | ||||
| HbA1c (%) | N = 79 | N = 79 | N = 85 | N = 76 |
| Baseline (gennemsnit) | 10.4 | 10.2 | 10.2 | 10.3 |
| Skift fra basislinje (justeret gennemsnit+) | 0.7 | -0.3 | -0.3 | -0.9 |
| Forskel fra placebo (justeret gennemsnit+) | -1.0* | -1.0* | -1.6* | |
| FPG (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Baseline (gennemsnit) | 268 | 267 | 269 | 276 |
| Skift fra basislinje (justeret gennemsnit+) | 9 | -30 | -32 | -56 |
| Forskel fra placebo (justeret gennemsnit+) | -39* | -41* | -65* | |
|
+ Justeret for baseline, pool-center og pool-center ved behandlingsinteraktion * p â ‰ ¤ 0,050 vs. placebo |
Undersøgelsespopulationen omfattede patienter, der ikke tidligere var behandlet med antidiabetika (nave; 31%) og patienter, der modtog antidiabetisk medicin på tidspunktet for studietilmelding (tidligere behandlet; 69%). Dataene for de nave og tidligere behandlede patientundersæt er vist i tabel 3. Alle patienter indgik i en 8 ugers udvasknings- / indkøringsperiode før dobbeltblind behandling. Denne indkøringsperiode var forbundet med lidt ændring i HbA1c og FPG-værdier fra screening til baseline for de nave patienter; for den tidligere behandlede gruppe resulterede udvaskning fra tidligere antidiabetisk medicin imidlertid i forringelse af glykæmisk kontrol og stigninger i HbA1c og FPG. Selvom de fleste patienter i den tidligere behandlede gruppe havde et fald fra baseline i HbA1c og FPG med Actos, i mange tilfælde vendte værdierne ikke tilbage til screeningsniveauer ved undersøgelsens afslutning. Undersøgelsesdesignet tillader ikke evaluering af patienter, der skiftede direkte til Actos fra et andet antidiabetisk middel.
Tabel 3 Glykæmiske parametre i en 26-ugers placebokontrolleret doserangerende undersøgelse
| Placebo | Actos 15 mg Enkelt gang Daglige |
Actos 30 mg Enkelt gang Daglige |
Actos 45 mg Enkelt gang Daglige |
|
| Nave til terapi HbA1c (%) |
N = 25 | N = 26 | N = 26 | N = 21 |
| Screening (gennemsnit) | 9.3 | 10.0 | 9.5 | 9.8 |
| Baseline (gennemsnit) | 9.0 | 9.9 | 9.3 | 10.0 |
| Skift fra basislinje (justeret gennemsnit *) | 0.6 | -0.8 | -0.6 | -1.9 |
| Forskel fra placebo (justeret middelværdi *) | -1.4 | -1.3 | -2.6 | |
| FPG (mg / dL) | N = 25 | N = 26 | N = 26 | N = 21 |
| Screening (gennemsnit) | 223 | 245 | 239 | 239 |
| Baseline (gennemsnit) | 229 | 251 | 225 | 235 |
| Skift fra basislinje (justeret gennemsnit *) | 16 | -37 | -41 | -64 |
| Forskel fra placebo (justeret middelværdi *) | -52 | -56 | -80 | |
| Tidligere behandlet HbA1c (%) |
N = 54 | N = 53 | N = 59 | N = 55 |
| Screening (gennemsnit) | 9.3 | 9.0 | 9.1 | 9.0 |
| Baseline (gennemsnit) | 10.9 | 10.4 | 10.4 | 10.6 |
| Skift fra basislinje (justeret gennemsnit *) | 0.8 | -0.1 | -0.0 | -0.6 |
| Forskel fra placebo (justeret middelværdi *) | -1.0 | -0.9 | -1.4 | |
| FPG (mg / dL) | N = 54 | N = 53 | N = 58 | N = 56 |
| Screening (gennemsnit) | 222 | 209 | 230 | 215 |
| Baseline (gennemsnit) | 285 | 275 | 286 | 292 |
| Skift fra basislinje (justeret gennemsnit *) | 4 | -32 | -27 | -55 |
| Forskel fra placebo (justeret middelværdi *) | -36 | -31 | -59 | |
| * Justeret til baseline og pooled center |
I en 24-ugers, placebokontrolleret undersøgelse blev 260 patienter med type 2-diabetes randomiseret til en af to Acto-behandlingsgrupper med tvungen titrering eller en placebogruppe med en spot-titrering. Behandling med ethvert tidligere antidiabetisk middel blev afbrudt 6 uger før den dobbeltblinde periode. I en Actos-behandlingsgruppe fik patienterne en initial dosis på 7,5 mg en gang dagligt. Efter fire uger blev dosis øget til 15 mg en gang dagligt, og efter yderligere fire uger blev dosis øget til 30 mg en gang dagligt for den resterende del af undersøgelsen (16 uger). I den anden Actos-behandlingsgruppe modtog patienter en initial dosis på 15 mg en gang dagligt og blev titreret til 30 mg en gang dagligt og 45 mg en gang dagligt på en lignende måde. Behandling med Actos, som beskrevet, frembragte statistisk signifikante forbedringer i HbA1c og FPG ved slutpunkt sammenlignet med placebo (tabel 4).
Tabel 4 Glykæmiske parametre i en 24-ugers placebokontrolleret tvangstitreringsundersøgelse
| Placebo | Actos 30 mg+ En gang dagligt |
Actos 45 mg+ En gang dagligt |
|
| Samlet befolkning HbA1c (%) |
N = 83 | N = 85 | N = 85 |
| Baseline (gennemsnit) | 10.8 | 10.3 | 10.8 |
| Skift fra basislinje (justeret gennemsnit++) | 0.9 | -0.6 | -0.6 |
| Forskel fra placebo (justeret gennemsnit++) | -1.5* | -1.5* | |
| FPG (mg / dL) | N = 78 | N = 82 | N = 85 |
| Baseline (gennemsnit) | 279 | 268 | 281 |
| Skift fra basislinje (justeret gennemsnit++) | 18 | -44 | -50 |
| Forskel fra placebo (justeret gennemsnit++) | -62* | -68* | |
|
+ Endelig dosis i tvungen titrering ++ Justeret for baseline, pool-center og pool-center ved behandlingsinteraktion * p â ‰ ¤ 0,050 vs. placebo |
For patienter, der ikke tidligere var blevet behandlet med antidiabetisk medicin (24%), var middelværdierne ved screening 10,1% for HbA1c og 238 mg / dL for FPG. Ved baseline betyder middel HbA1c var 10,2%, og gennemsnitligt FPG var 243 mg / dL. Sammenlignet med placebo resulterede behandling med Actos titreret til en slutdosis på 30 mg og 45 mg i reduktioner fra basislinien i middel HbA1c på 2,3% og 2,6% og et gennemsnitligt FPG på henholdsvis 63 mg / dL og 95 mg / dL. For patienter, der tidligere var blevet behandlet med antidiabetisk medicin (76%), blev denne medicin stoppet ved screening. Middelværdier ved screening var 9,4% for HbA1c og 216 mg / dL for FPG. Ved baseline betyder middel HbA1c var 10,7%, og det gennemsnitlige FPG var 290 mg / dL. Sammenlignet med placebo resulterede behandling med Actos titreret til en slutdosis på 30 mg og 45 mg i reduktioner fra basislinien i middel HbA1c på 1,3% og 1,4% og et gennemsnitligt FPG på henholdsvis 55 mg / dL og 60 mg / dL. For mange tidligere behandlede patienter, HbA1c og FPG var ikke vendt tilbage til screeningsniveauer i slutningen af undersøgelsen.
I en 16-ugers undersøgelse blev 197 patienter med type 2-diabetes randomiseret til behandling med 30 mg Actos eller placebo en gang dagligt. Behandling med ethvert tidligere antidiabetisk middel blev afbrudt 6 uger før den dobbeltblinde periode. Behandling med 30 mg Actos producerede statistisk signifikante forbedringer i HbA1c og FPG ved slutpunkt sammenlignet med placebo (tabel 5).
Tabel 5 Glykæmiske parametre i en 16-ugers placebokontrolleret undersøgelse
| Placebo | Actos 30 mg En gang dagligt |
|
| Samlet befolkning HbA1c (%) |
N = 93 | N = 100 |
| Baseline (gennemsnit) | 10.3 | 10.5 |
| Skift fra basislinje (justeret gennemsnit+) | 0.8 | -0.6 |
| Forskel fra placebo (justeret gennemsnit+) | -1.4* | |
| FPG (mg / dL) | N = 91 | N = 99 |
| Baseline (gennemsnit) | 270 | 273 |
| Skift fra basislinje (justeret gennemsnit+) | 8 | -50 |
| Forskel fra placebo (justeret gennemsnit+) | -58* | |
|
+ Justeret for baseline, pool-center og pool-center ved behandlingsinteraktion * p â ‰ ¤ 0,050 vs. placebo |
For patienter, der ikke tidligere var blevet behandlet med antidiabetisk medicin (40%), var middelværdierne ved screening 10,3% for HbA1c og 240 mg / dL for FPG. Ved baseline betyder middel HbA1c var 10,4%, og det gennemsnitlige FPG var 254 mg / dL. Sammenlignet med placebo resulterede behandling med Actos 30 mg i reduktioner fra basislinien i middel HbA1c på 1,0% og et gennemsnitligt FPG på 62 mg / dL. For patienter, der tidligere var blevet behandlet med antidiabetisk medicin (60%), blev denne medicin stoppet ved screening. Middelværdier ved screening var 9,4% for HbA1c og 216 mg / dL for FPG. Ved baseline betyder middel HbA1c var 10,6%, og det gennemsnitlige FPG var 287 mg / dL. Sammenlignet med placebo resulterede behandling med Actos 30 mg i reduktioner fra basislinien i middel HbA1c på 1,3% og et gennemsnitligt FPG på 46 mg / dL. For mange tidligere behandlede patienter, HbA1c og FPG var ikke vendt tilbage til screeningsniveauer i slutningen af undersøgelsen.
Kombinationsterapi
Tre 16-ugers, randomiserede, dobbeltblinde, placebokontrollerede kliniske studier og tre 24-ugers, randomiserede, dobbeltblinde, dosis-kontrollerede kliniske undersøgelser blev udført for at evaluere virkningen af Actos på glykæmisk kontrol hos patienter med type 2-diabetes, som var utilstrækkeligt kontrolleret (HbA1c â € 8%) trods den aktuelle behandling med en sulfonylurinstof, metformin eller insulin. Tidligere diabetesbehandling kan have været monoterapi eller kombinationsterapi.
Actos Plus Sulfonylurea-undersøgelser
To kliniske undersøgelser blev udført med Actos i kombination med en sulfonylurinstof. Begge studier inkluderede patienter med type 2-diabetes på en sulfonylurinstof, enten alene eller i kombination med et andet antidiabetisk middel. Alle andre antidiabetika blev trukket tilbage inden behandlingsstart. I den første undersøgelse blev 560 patienter randomiseret til at modtage 15 mg eller 30 mg Actos eller placebo en gang dagligt i 16 uger ud over deres nuværende sulfonylurinstofregime. Sammenlignet med placebo i uge 16 reducerede tilsætningen af Actos til sulfonylurinstoffet betydeligt HbA1c med 0,9% og 1,3% og gennemsnitligt FPG med 39 mg / dL og 58 mg / dL for henholdsvis 15 mg og 30 mg doser.
I den anden undersøgelse blev 702 patienter randomiseret til at modtage 30 mg eller 45 mg Actos en gang dagligt i 24 uger ud over deres nuværende sulfonylurinstofregime. De gennemsnitlige reduktioner fra baseline i uge 24 i HbA1c var 1,55% og 1,67% for henholdsvis 30 mg og 45 mg doser. Gennemsnitlige reduktioner fra baseline i FPG var 51,5 mg / dL og 56,1 mg / dL.
Den terapeutiske virkning af Actos i kombination med sulfonylurinstof blev observeret hos patienter, uanset om patienterne modtog lave, mellemstore eller høje doser sulfonylurinstof.
Actos Plus Metformin-undersøgelser
To kliniske undersøgelser blev udført med Actos i kombination med metformin. Begge studier inkluderede patienter med type 2-diabetes på metformin, enten alene eller i kombination med et andet antidiabetisk middel. Alle andre antidiabetika blev trukket tilbage inden behandlingsstart. I den første undersøgelse blev 328 patienter randomiseret til at modtage enten 30 mg Actos eller placebo en gang dagligt i 16 uger ud over deres nuværende metforminregime. Sammenlignet med placebo i uge 16 reducerede tilsætningen af Actos til metformin det gennemsnitlige HbA signifikant1c med 0,8% og faldt den gennemsnitlige FPG med 38 mg / dL.
I den anden undersøgelse blev 827 patienter randomiseret til at modtage enten 30 mg eller 45 mg Actos en gang dagligt i 24 uger ud over deres nuværende metforminregime. De gennemsnitlige reduktioner fra baseline i uge 24 i HbA1c var 0,80% og 1,01% for henholdsvis 30 mg og 45 mg doser. Gennemsnitlige reduktioner fra basislinien i FPG var 38,2 mg / dL og 50,7 mg / dL.
Den terapeutiske virkning af Actos i kombination med metformin blev observeret hos patienter, uanset om patienterne fik lavere eller højere doser af metformin.
Actos Plus-insulinundersøgelser
To kliniske undersøgelser blev udført med Actos i kombination med insulin. Begge studier inkluderede patienter med type 2-diabetes på insulin, enten alene eller i kombination med et andet antidiabetisk middel. Alle andre antidiabetika blev trukket tilbage inden behandlingsstart. I den første undersøgelse blev 566 patienter, der fik en median på 60,5 enheder pr. Dag insulin, randomiseret til modtager enten 15 mg eller 30 mg Actos eller placebo en gang dagligt i 16 uger ud over deres insulin regime. Sammenlignet med placebo i uge 16 reducerede tilsætningen af Actos til insulin signifikant begge HbA1c med 0,7% og 1,0% og FPG med 35 mg / dL og 49 mg / dL for henholdsvis 15 mg og 30 mg dosis.
I den anden undersøgelse modtog 690 patienter, der fik en median på 60,0 enheder pr. Dag insulin, enten 30 mg eller 45 mg Actos en gang dagligt i 24 uger ud over deres nuværende insulinregime. De gennemsnitlige reduktioner fra baseline i uge 24 i HbA1c var 1,17% og 1,46% for henholdsvis 30 mg og 45 mg doser. Gennemsnitlige reduktioner fra baseline i FPG var 31,9 mg / dL og 45,8 mg / dL. Forbedret glykæmisk kontrol blev ledsaget af gennemsnitlige fald fra baseline i insulindosisbehov på 6,0% og 9,4% pr. Dag for henholdsvis 30 mg og 45 mg dosis.
Den terapeutiske virkning af Actos i kombination med insulin blev observeret hos patienter, uanset om patienterne fik lavere eller højere doser insulin.
top
Indikationer og anvendelse
Actos er indikeret som et supplement til diæt og motion for at forbedre den glykæmiske kontrol hos voksne med type 2-diabetes mellitus.
top
Kontraindikationer
Påbegyndelse af Actos hos patienter med etableret New York Heart Association (NYHA) hjertesvigt i klasse III eller IV er kontraindiceret (se BOKSET ADVARSEL).
Actos er kontraindiceret til patienter med kendt overfølsomhed over for dette produkt eller en af dets komponenter.
top
Advarsler
Hjertesvigt og andre hjertevirkninger
Actos kan som andre thiazolidinedioner forårsage væskeretention, når de bruges alene eller i kombination med andre antidiabetika, inklusive insulin. Væskeretention kan føre til eller forværre hjertesvigt. Patienter skal overholdes for tegn og symptomer på hjertesvigt. Hvis disse tegn og symptomer udvikler sig, skal hjertesvigt håndteres i henhold til de aktuelle plejestandarder. Desuden skal seponering eller dosisreduktion af Actos overvejes (se BOKSET ADVARSEL). Patienter med hjertestatus i NYHA klasse III og IV blev ikke undersøgt under kliniske forsøg med forudgående godkendelse, og Actos anbefales ikke til disse patienter (se BOKSET ADVARSEL og KONTRAINDIKATIONER).
I en 16-ugers amerikansk dobbeltblind, placebokontrolleret klinisk forsøg, der involverede 566 patienter med type 2 diabetes, blev Actos i doser på 15 mg og 30 mg i kombination med insulin sammenlignet med insulinbehandling alene. Dette forsøg omfattede patienter med langvarig diabetes og en høj forekomst af præ-eksisterende medicinske tilstande som følger: arteriel hypertension (57,2%), perifer neuropati (22,6%), koronar hjertesygdom (19,6%), retinopati (13,1%), myokardie infarkt (8,8%), vaskulær sygdom (6,4%), angina pectoris (4,4%), slagtilfælde og / eller kortvarigt iskæmisk angreb (4,1%) og kongestiv hjertesvigt (2,3%).
I denne undersøgelse modtog to af de 191 patienter, der fik 15 mg Actos plus insulin (1,1%), og to af de 188 patienter, der fik 30 mg Actos plus insulin (1,1%) udviklede kongestiv hjertesvigt sammenlignet med ingen af de 187 patienter alene på insulinbehandling. Alle fire af disse patienter havde tidligere historier om hjerte-kar-sygdomme, herunder koronar arteriesygdom, tidligere CABG-procedurer og myokardieinfarkt. I en 24-ugers, dosisstyret undersøgelse, hvor Actos blev administreret sammen med insulin, rapporterede 0,3% af patienterne (1/345) på 30 mg og 0,9% (3/345) af patienterne på 45 mg CHF som en alvorlig bivirkning .
Analyse af data fra disse studier identificerede ikke specifikke faktorer, der forudsiger øget risiko for kongestiv hjertesvigt ved kombinationsterapi med insulin.
Ved type 2-diabetes og kongestiv hjertesvigt (systolisk dysfunktion)
En 24-ugers sikkerhedsundersøgelse efter markedsføring blev udført for at sammenligne Actos (n = 262) med glyburid (n = 256) hos ukontrollerede diabetespatienter (middel HbA1c 8,8% ved baseline) med NYHA klasse II og III hjertesvigt og udkast til fraktion mindre end 40% (gennemsnitlig EF 30% ved baseline). I løbet af undersøgelsen blev der rapporteret om hospitalisering natten over for kongestiv hjertesvigt hos 9,9% af patienter på Actos sammenlignet med 4,7% af patienterne på glyburid med en forskelle i behandlingen observeret fra 6 uger. Denne bivirkning forbundet med Actos var mere markant hos patienter, der brugte insulin ved baseline og hos patienter over 64 år. Der blev ikke observeret nogen forskel i kardiovaskulær dødelighed mellem behandlingsgrupperne.
Actos skal initieres i den laveste godkendte dosis, hvis det er ordineret til patienter med type 2-diabetes og systolisk hjertesvigt (NYHA klasse II). Hvis efterfølgende eskalering af dosis er nødvendig, skal dosis øges gradvist efter flere måneders behandling med omhyggelig monitorering for vægtøgning, ødemer eller tegn og symptomer på CHF forværring.
Prospektiv klinisk forsøg med Pioglitazon i makrovaskulære begivenheder (PROactive)
I PROactive blev 5238 patienter med type 2-diabetes og en tidligere historie med makrovaskulær sygdom behandlet med Actos (n = 2605), krafttitreret op til 45 mg en gang dagligt eller placebo (n = 2633) (se BIVIRKNINGER). Procentdelen af patienter, der havde haft en alvorlig hjertesvigt, var højere for patienter behandlet med Actos (5,7%, n = 149) end for patienter, der blev behandlet med placebo (4,1%, n = 108). Dødsfaldet efter en rapport om alvorlig hjertesvigt var 1,5% (n = 40) hos patienter behandlet med Actos og 1,4% (n = 37) hos placebo-behandlede patienter. Hos patienter, der blev behandlet med et insulinholdigt regime ved basislinjen, var hyppigheden af alvorlig hjertesvigt 6,3% (n = 54/864) med Actos og 5,2% (n = 47/896) med placebo. For de patienter, der blev behandlet med et sulfonylurinstof-indeholdende regime ved basislinjen, var hyppigheden af alvorlig hjertesvigt 5,8% (n = 94/1624) med Actos og 4,4% (n = 71/1626) med placebo.
top
Forholdsregler
Generel
Actos udøver kun sin antihyperglykæmiske virkning i nærværelse af insulin. Derfor bør Actos ikke bruges til patienter med type 1-diabetes eller til behandling af diabetisk ketoacidose.
Hypoglykæmi: Patienter, der får Actos i kombination med insulin eller orale hypoglykæmiske stoffer, kan være i risiko for hypoglykæmi, og en reduktion i dosis af det samtidige middel kan være nødvendigt.
Kardiovaskulær: I U.S. placebokontrollerede kliniske forsøg, som udelukkede patienter med New York Heart Association (NYHA) klasse III og IV hjertestatus, var hyppigheden af alvorlige hjertebivirkninger relateret til volumenekspansion blev ikke forøget hos patienter, der blev behandlet med Actos som monoterapi eller i kombination med sulfonylurinstoffer eller metformin vs. placebo-behandlede patienter. I insulin kombination studier, et lille antal patienter med en tidligere historie hjertesygdom udviklede kongestiv hjertesvigt, når de blev behandlet med Actos i kombination med insulin (se ADVARSLER). Patienter med hjertestatus i NYHA klasse III og IV blev ikke undersøgt i disse kliniske forsøg med Actos. Actos er ikke indiceret til patienter med NYHA klasse III eller IV hjertestatus.
Efter markedsføring med Actos er der rapporteret tilfælde af kongestiv hjertesvigt hos patienter både med og uden tidligere kendt hjertesygdom.
Ødem: Actos bør anvendes med forsigtighed til patienter med ødem. I alle amerikanske kliniske forsøg blev ødemer rapporteret hyppigere hos patienter behandlet med Actos end hos placebo-behandlede patienter og ser ud til at være dosisrelateret (se BIVIRKNINGER). Efter markedsføring er der modtaget rapporter om påbegyndelse eller forværring af ødemer. Da thiazolidinedioner, inklusive Actos, kan forårsage væskeretention, hvilket kan forværre eller føre til kongestiv hjertesvigt, skal Actos anvendes med forsigtighed hos patienter, der er i risiko for hjertesvigt. Patienter skal overvåges for tegn og symptomer på hjertesvigt (se BOKSET ADVARSEL, ADVARSLER, og FORHOLDSREGLER).
Vægtforøgelse: Dosisrelateret vægtøgning blev set kun med Actos og i kombination med andre hypoglykæmiske midler (tabel 6). Mekanismen for vægtøgning er uklar, men involverer sandsynligvis en kombination af væskeretention og fedtophobning.
Tabel 6 Vægtændringer (kg) fra baseline under dobbeltblinde kliniske forsøg med Actos
| Kontrolgruppe (Placebo) |
Actos 15 mg |
Actos 30 mg |
Actos 45 mg |
||
| median (25th/75th percentil) |
median (25th/75th percentil) |
median (25th/75th percentil) |
median (25th/75th percentil) |
||
| monoterapi | -1.4 (-2.7/0.0) n = 256 |
0.9(-0.5/3.4) n = 79 |
1.0(-0.9/3.4) n = 188 |
2.6 (0.2/5.4) n = 79 |
|
| Kombinationsterapi | sulfonylurinstof | -0.5 (-1.8/0.7) n = 187 |
2.0 (0.2/3.2) n = 183 |
3.1 (1.1/5.4) n = 528 |
4.1 (1.8/7.3) n = 333 |
| Metformin | -1.4 (-3.2/0.3) n = 160 |
N / A | 0.9(-0.3/3.2) n = 567 |
1.8(-0.9/5.0) n = 407 |
|
| Insulin | 0.2 (-1.4/1.4) n = 182 |
2.3 (0.5/4.3) n = 190 |
3.3 (0.9/6.3) n = 522 |
4.1 (1.4/6.8) n = 338 |
|
| Bemærk: Testperioder på 16 til 26 uger |
Ægløsning: Behandling med Actos, ligesom andre thiazolidinedioner, kan resultere i ægløsning hos nogle prævenopausale anovulatoriske kvinder. Som et resultat kan disse patienter have en øget risiko for graviditet, mens de tager Actos. Derfor bør der anbefales tilstrækkelig antikonception hos kvinder, der er præmenopausale. Denne mulige effekt er ikke undersøgt i kliniske studier, så hyppigheden af denne forekomst ikke er kendt.
Hæmatologisk: Actos kan forårsage fald i hæmoglobin og hæmatokrit. I alle kliniske studier faldt de gennemsnitlige hæmoglobinværdier med 2% til 4% hos patienter behandlet med Actos. Disse ændringer forekom primært inden for de første 4 til 12 uger af terapi og forblev relativt konstant derefter. Disse ændringer kan være relateret til øget plasmavolumen og har sjældent været forbundet med nogen signifikant hæmatologisk klinisk effekt (se BIVIRKNINGER, Laboratorie abnormiteter).
Levereffekter: I kliniske undersøgelser med forudgående godkendelse overalt i verden blev over 4500 forsøgspersoner behandlet med Actos. I amerikanske kliniske studier modtog over 4700 patienter med type 2-diabetes Actos. Der var ingen tegn på lægemiddelinduceret hepatotoksicitet eller forhøjelse af ALT-niveauer i de kliniske studier.
Under placebo-kontrollerede kliniske forsøg med godkendelse i forudgående godkendelse i U.S.A. var i alt 4 af 1526 (0,26%) patienter behandlet med Actos og 2 ud af 793 (0,25%) placebo-behandlede patienter havde ALT-værdier - 3 gange den øvre grænse for normal. ALT-forhøjelserne hos patienter behandlet med Actos var reversible og var ikke klart relateret til terapi med Actos.
Efter markedsføring med Actos er der modtaget rapporter om hepatitis og forhøjelser af leverenzym til 3 eller flere gange den øvre normalgrænse. Meget sjældent har disse rapporter involveret leversvigt med og uden fatalt resultat, skønt kausalitet ikke er blevet konstateret.
I afventning af tilgængeligheden af resultaterne af yderligere store, langvarige kontrollerede kliniske forsøg og yderligere efter markedsføring af sikkerhedsdata anbefales det, at patienter, der behandles med Actos, gennemgår periodisk leveringsovervågning enzymer.
Serum-ALT-niveauer (alaninaminotransferase) skal evalueres inden påbegyndelse af behandling med Actos hos alle patienter og derefter periodisk efter den kliniske vurdering af sundhedsvæsenet professionel. Leverfunktionsundersøgelser bør også opnås for patienter, hvis der forekommer symptomer, der tyder på leverdysfunktion, fx kvalme, opkast, mavesmerter, træthed, anoreksi eller mørk urin. Beslutningen om, hvorvidt patienten skal fortsætte behandlingen med Actos, bør styres af en klinisk vurdering i afventning af laboratorievurderinger. Hvis der observeres gulsot, skal lægemiddelbehandling seponeres.
Behandling med Actos bør ikke påbegyndes, hvis patienten udviser klinisk bevis for aktiv leversygdom, eller ALT-niveauerne overstiger 2,5 gange den øvre normalgrænse. Patienter med let forhøjede leverenzymer (ALT-niveauer fra 1 til 2,5 gange den øvre normalgrænse) kl baseline eller ethvert tidspunkt under terapi med Actos bør evalueres for at bestemme årsagen til leverenzymet elevation. Påbegyndelse eller fortsættelse af behandling med Actos hos patienter med mildt forhøjede leverenzymer bør fortsætte med forsigtighed og inkludere passende klinisk opfølgning, som kan omfatte hyppigere leverenzym overvågning. Hvis serumtransaminaseniveauet øges (ALT> 2,5 gange den øvre normalgrænse), leveren funktionstests skal evalueres hyppigere, indtil niveauerne vender tilbage til normal eller forbehandling værdier. Hvis ALT-niveauer overstiger 3 gange den øvre normalgrænse, skal testen gentages så hurtigt som muligt. Hvis ALT-niveauer forbliver> 3 gange den øvre normalgrænse, eller hvis patienten er gulsot, skal Actos-behandlingen seponeres.
Makulært ødem: Makulært ødem er rapporteret efter markedsføring hos diabetespatienter, der tog pioglitazon eller en anden thiazolidinedion. Nogle patienter præsenteres med sløret syn eller nedsat synsskarphed, men nogle patienter ser ud til at være diagnosticeret ved rutinemæssig øjenundersøgelse. Nogle patienter havde perifert ødem på det tidspunkt, hvor makulært ødem blev diagnosticeret. Nogle patienter havde forbedring af deres makulære ødemer efter seponering af deres thiazolidinedion. Det er ukendt, om der er en årsagssammenhæng mellem pioglitazon og makulært ødem. Patienter med diabetes skal have regelmæssige øjeundersøgelser af en øjenlæge i henhold til standarderne for pleje af American Diabetes Association. Derudover skal enhver diabetiker, der rapporterer nogen form for visuelt symptom, straks henvises til en øjenlæge, uanset patientens underliggende medicin eller andre fysiske fund (se BIVIRKNINGER).
Frakturer: I et randomiseret forsøg (PROactive) hos patienter med type 2-diabetes (middelvarighed på diabetes 9,5 år) blev der observeret en øget forekomst af knogelfraktur hos kvindelige patienter, der tog pioglitazon. Under en gennemsnitlig opfølgning på 34,5 måneder var forekomsten af knoglebrud hos kvinder 5,1% (44/870) for pioglitazon mod 2,5% (23/905) for placebo. Denne forskel blev bemærket efter det første behandlingsår og forblev i løbet af studiet. Størstedelen af frakturer, der blev observeret hos kvindelige patienter, var nonvertebrale frakturer, herunder underekstremitet og distalt øvre lem. Der blev ikke observeret nogen stigning i brudhastigheder hos mænd behandlet med pioglitazon 1,7% (30/1735) mod placebo 2,1% (37/1728). Risikoen for brud bør overvejes ved pleje af patienter, især kvindelige patienter, der er behandlet med pioglitazon og opmærksomhed bør rettes mod vurdering og opretholdelse af knoglesundhed i henhold til de nuværende standarder af pleje.
Makrovaskulære resultater: Der har ikke været nogen kliniske undersøgelser, der viser, at der foreligger afgørende bevis for reduktion af makrovaskulær risiko med Actos eller noget andet diabetisk middel.
Laboratorietest
FPG og HbA1c målinger udføres med jævne mellemrum for at overvåge glykæmisk kontrol og det terapeutiske respons på Actos.
Leverenzymovervågning anbefales inden påbegyndelse af terapi med Actos hos alle patienter og periodisk derefter efter den kliniske vurdering af sundhedspersonalet (se FORHOLDSREGLER, Generelle, levereffekter og BIVIRKNINGER, Serumtransaminase niveauer).
Oplysninger til patienter
Det er vigtigt at instruere patienterne at overholde diætinstruktioner og at få blodglukose og glykosyleret hæmoglobin testet regelmæssigt. I perioder med stress som feber, traumer, infektion eller kirurgi kan medicinkrav ændres, og patienter skal mindes om at omgående søge læge.
Patienter, der oplever en usædvanlig hurtig stigning i vægt eller ødemer, eller som udvikler åndenød eller andre symptomer på hjertesvigt, mens de er på Actos, skal straks rapportere disse symptomer til deres læge.
Patienter skal informeres om, at blodprøver for leverfunktion vil blive udført inden behandlingsstart og derefter regelmæssigt efter den kliniske vurdering af sundhedspersonalet. Patienter skal bedes om at omgående søge læge for uforklarlig kvalme, opkast, mavesmerter, træthed, anorexi eller mørk urin.
Patienterne skal få besked om at tage Actos en gang dagligt. Actos kan tages med eller uden måltider. Hvis en dosis går glip af en dag, bør dosis ikke fordobles den følgende dag.
Når du bruger kombinationsterapi med insulin eller orale hypoglykæmiske midler, er risikoen for hypoglykæmi, dens symptomer og behandling og forhold, der disponerer for dens udvikling, skal forklares til patienter og deres familie medlemmer.
Terapi med Actos, ligesom andre thiazolidinedioner, kan resultere i ægløsning hos nogle prævenopausale anovulatoriske kvinder. Som et resultat kan disse patienter have en øget risiko for graviditet, mens de tager Actos. Derfor bør der anbefales tilstrækkelig antikonception hos kvinder, der er præmenopausale. Denne mulige effekt er ikke undersøgt i kliniske studier, så hyppigheden af denne forekomst ikke er kendt.
Lægemiddelinteraktioner
In vivo-lægemiddelinteraktionsundersøgelser har antydet, at pioglitazon kan være en svag inducer af CYP 450 isoform 3A4-substrat (se KLINISK FARMAKOLOGI, Stofskifte og Drug-Drug Interactions).
En enzyminhibitor af CYP2C8 (såsom gemfibrozil) kan øge AUC for signifikant pioglitazon og en enzyminducer af CYP2C8 (såsom rifampin) kan reducere AUC for pioglitazon. Derfor, hvis en hæmmer eller inducer af CYP2C8 startes eller stoppes under behandling med pioglitazon, kan der være behov for ændringer i diabetesbehandling baseret på klinisk respons (se KLINISK FARMAKOLOGI, Drug-Drug Interactions).
Karcinogenese, mutagenese, forringelse af fertilitet
En to-årig carcinogenicitetsundersøgelse blev udført hos han- og hunrotter i orale doser op til 63 mg / kg (ca. 14 gange den maksimale anbefalede, orale dosis til mennesker på 45 mg baseret på mg / m2). Lægemiddelinducerede tumorer blev ikke observeret i noget organ undtagen urinblæren. Godartede og / eller maligne overgangscelleneoplasmer blev observeret hos hanrotter ved 4 mg / kg / dag og derover (omtrent lig med den maksimale anbefalede orale dosis til mennesker baseret på mg / m2). En to-årig carcinogenicitetsundersøgelse blev udført hos han- og hunmus i orale doser op til 100 mg / kg / dag (ca. 11 gange den maksimale anbefalede orale dosis til mennesker baseret på mg / m2). Ingen medikamentinducerede tumorer blev observeret i noget organ.
Under fremtidig evaluering af urincytologi, der involverede mere end 1800 patienter, der modtog Actos i kliniske forsøg op til et års varighed, blev der ikke identificeret nye tilfælde af blæretumorer. I to 3-årige undersøgelser, hvor pioglitazon blev sammenlignet med placebo eller glyburid, var der 16/3656 (0,44%) rapporter om blærekræft hos patienter, der tager pioglitazon sammenlignet med 5/3679 (0,14%) hos patienter, der ikke tager pioglitazon. Efter at have udelukket patienter, hvor eksponeringen for undersøgelsesmedicin var mindre end et år på diagnosetidspunktet for blærekræft, var der seks (0,16%) tilfælde af pioglitazon og to (0,05%) med placebo.
Pioglitazone HCl var ikke mutagent i et batteri af genetiske toksikologiske undersøgelser, herunder Ames-bakterieanalysen, et pattedyrcellefremvisningsgen mutationsassay (CHO / HPRT og AS52 / XPRT), et in vitro cytogenetisk assay ved anvendelse af CHL-celler, et ikke-planlagt DNA-synteseassay og en in vivo-mikronukleus assay.
Der blev ikke observeret bivirkninger på fertiliteten hos han- og hunrotter ved orale doser op til 40 mg / kg pioglitazon HCl dagligt før og igennem parring og drægtighed (ca. 9 gange den maksimale anbefalede orale dosis til mennesker baseret på mg / m2).
Dyretoksikologi
Hjerteforstørrelse er observeret hos mus (100 mg / kg), rotter (4 mg / kg og derover) og hunde (3 mg / kg) behandlet oralt med pioglitazon HCI (ca. 11, 1 og 2 gange den maksimale anbefalede orale dosis til mennesker til henholdsvis mus, rotter og hunde, baseret på mg / m2). I et års rottestudie forekom lægemiddelrelateret tidlig død på grund af tilsyneladende hjertedysfunktion ved en oral dosis på 160 mg / kg / dag (ca. 35 gange den maksimale anbefalede orale dosis til mennesker baseret på mg / m2). Hjerteforstørrelse blev set i et 13-ugers forsøg med aber i orale doser på 8,9 mg / kg og derover (ca. 4 gange den maksimale anbefalede orale dosis til mennesker baseret på mg / m2), men ikke i et 52-ugers forsøg med orale doser op til 32 mg / kg (ca. 13 gange den maksimale anbefalede orale dosis til mennesker baseret på mg / m2).
Graviditet
Graviditet kategori C. Pioglitazon var ikke teratogent hos rotter ved orale doser op til 80 mg / kg eller hos kaniner op til 160 mg / kg under organogenese (ca. 17 og 40 gange den maksimale anbefalede humane orale dosis baseret på mg / m2, henholdsvis). Forsinket fødsel og embryotoksicitet (hvilket fremgår af øget postimplantationstab, forsinket udvikling og reduceret fostervægt) blev observeret i rotter ved orale doser på 40 mg / kg / dag og derover (ca. 10 gange den maksimale anbefalede orale dosis til mennesker baseret på mg / m2). Der blev ikke observeret nogen funktionel eller adfærdsmæssig toksicitet hos afkom af rotter. Hos kaniner blev embryotoksicitet observeret i en oral dosis på 160 mg / kg (ca. 40 gange den maksimale anbefalede orale dosis til mennesker baseret på mg / m2). Forsinket postnatal udvikling, tilskrevet nedsat kropsvægt, blev observeret hos afkom af rotter ved orale doser på 10 mg / kg og derover i sene drægtigheds- og ammeperioder (ca. 2 gange den maksimale anbefalede orale dosis til mennesker baseret på mg / m2).
Der er ingen tilstrækkelige og godt kontrollerede studier på gravide kvinder. Actos bør kun bruges under graviditet, hvis den potentielle fordel retfærdiggør den potentielle risiko for fosteret.
Fordi de nuværende oplysninger kraftigt antyder, at unormale blodsukkerniveauer under graviditet er forbundet med en højere forekomst af medfødte afvigelser, så godt som øget neonatal sygelighed og dødelighed, anbefaler de fleste eksperter, at insulin bruges under graviditet til at opretholde blodsukkerniveauet så tæt på det normale som muligt.
Sygeplejerske mødre
Pioglitazon udskilles i mælken hos ammende rotter. Det vides ikke, om Actos udskilles i modermælk. Da mange lægemidler udskilles i modermælk, bør Actos ikke administreres til en ammende kvinde.
Pædiatrisk brug
Sikkerhed og effektivitet af Actos hos pædiatriske patienter er ikke fastlagt.
Ældre brug
Cirka 500 patienter i placebokontrollerede kliniske forsøg med Actos var 65 år og derover. Der blev ikke observeret nogen signifikante forskelle i effektivitet og sikkerhed mellem disse patienter og yngre patienter.
top
Bivirkninger
Over 8500 patienter med type 2-diabetes er blevet behandlet med Actos i randomiserede, dobbeltblinde, kontrollerede kliniske forsøg. Dette inkluderer 2605 højrisikopatienter med type 2-diabetes behandlet med Actos fra det PROactive kliniske forsøg. Over 6000 patienter er blevet behandlet i 6 måneder eller længere og over 4500 patienter i et år eller længere. Over 3000 patienter har modtaget Actos i mindst 2 år.
Den samlede forekomst og typer bivirkninger rapporteret i placebokontrollerede kliniske forsøg med Actos monoterapi i doser på 7,5 mg, 15 mg, 30 mg eller 45 mg en gang dagligt er vist i tabel 7.
Tabel 7 Placebo-kontrollerede kliniske studier af Actos-monoterapi: Bivirkninger rapporteret ved en hyppighed - 5% af patienterne behandlet med Actos
| (% af patienterne) | ||
| Placebo N = 259 |
Actos N = 606 |
|
| Øvre luftvejsinfektion | 8.5 | 13.2 |
| Hovedpine | 6.9 | 9.1 |
| Bihulebetændelse | 4.6 | 6.3 |
| Myalgi | 2.7 | 5.4 |
| Tandeforstyrrelse | 2.3 | 5.3 |
| Diabetes Mellitus forværret | 8.1 | 5.1 |
| Pharyngitis | 0.8 | 5.1 |
For de fleste kliniske bivirkninger var forekomsten den samme for grupper behandlet med Actos monoterapi og dem, der blev behandlet i kombination med sulfonylurinstoffer, metformin og insulin. Der var en stigning i forekomsten af ødemer hos patienter behandlet med Actos og insulin sammenlignet med insulin alene.
I et 16-ugers placebo-kontrolleret Actos plus insulin forsøg (n = 379) behandlede 10 patienter med Actos plus insulin udviklede dyspnø og udviklede også på et tidspunkt under behandlingen enten vægtændring eller ødem. Syv af disse 10 patienter modtog diuretika til behandling af disse symptomer. Dette blev ikke rapporteret i insulin plus placebogruppen.
Forekomsten af abstinenser fra placebokontrollerede kliniske forsøg på grund af en anden bivirkning end hyperglykæmi var lignende for patienter, der blev behandlet med placebo (2,8%) eller Actos (3,3%).
I kontrollerede kombinationsbehandlingsundersøgelser med enten sulfonylurinstof eller insulin blev der rapporteret mild til moderat hypoglykæmi, som ser ud til at være dosisrelateret (se FORHOLDSREGLER, Generelt, Hypoglykæmi og DOSERING og ADMINISTRATION, Kombinationsterapi).
I amerikanske dobbeltblinde undersøgelser blev anæmi rapporteret hos â 2 of af patienterne behandlet med Actos plus sulfonylurinstof, metformin eller insulin (se FORHOLDSREGLER, Generelt, Hematologic).
I monoterapistudier blev ødemer rapporteret for 4,8% (med doser fra 7,5 mg til 45 mg) af patienter behandlet med Actos mod 1,2% af placebo-behandlede patienter. I kombinationsbehandlingsundersøgelser blev ødemer rapporteret for 7,2% af patienterne behandlet med Actos og sulfonylurea sammenlignet med 2,1% af patienterne, der kun havde sulfonylurinstoffer. I kombinationsbehandlingsundersøgelser med metformin blev ødemer rapporteret hos 6,0% af patienterne i kombinationsterapi sammenlignet med 2,5% af patienterne, der kun havde metformin. I kombinationsbehandlingsundersøgelser med insulin blev ødemer rapporteret hos 15,3% af patienterne i kombinationsterapi sammenlignet med 7,0% af patienterne på insulin alene. De fleste af disse begivenheder blev betragtet som milde eller moderate i intensitet (se FORHOLDSREGLER, General, ødem).
I et 16-ugers klinisk forsøg med insulin plus Actos-kombinationsterapi udviklede flere patienter kongestiv hjertesvigt ved kombinationsterapi (1,1%) sammenlignet med ingen på insulin alene (se ADVARSLER, Hjertesvigt og andre hjerteaffekter).
Prospektiv klinisk forsøg med Pioglitazon i makrovaskulære begivenheder (PROactive)
I PROactive var 5238 patienter med type 2-diabetes og en tidligere historie med makrovaskulær sygdom behandlet med Actos (n = 2605), krafttitreret op til 45 mg dagligt eller placebo (n = 2633) ud over standard af pleje. Næsten alle forsøgspersoner (95%) modtog kardiovaskulære medikamenter (betablokkere, ACE-hæmmere, ARB'er, calciumkanalblokkere, nitrater, diuretika, aspirin, statiner, fibrater). Patienter havde en gennemsnitsalder på 61,8 år, gennemsnitlig varighed af diabetes 9,5 år og gennemsnitlig HbA1c 8,1%. Gennemsnitlig opfølgningsvarighed var 34,5 måneder. Det primære mål med denne undersøgelse var at undersøge virkningen af Actos på dødelighed og makrovaskulær sygelighed hos patienter med type 2-diabetes mellitus, som var i høj risiko for makrovaskulære begivenheder. Den primære effektvariabel var tiden til den første forekomst af enhver begivenhed i det kardiovaskulære sammensatte slutpunkt (se tabel 8 nedenfor). Selvom der ikke var nogen statistisk signifikant forskel mellem Actos og placebo for den 3-årige forekomst af en første begivenhed inden for denne sammensatte var der ingen stigning i dødelighed eller i totale makrovaskulære begivenheder med Actos.
Tabel 8 Antal første og samlede begivenheder for hver komponent inden for det kardiovaskulære sammensatte slutpunkt
| Placebo N = 2633 |
Actos N = 2605 |
|||
| Kardiovaskulære begivenheder | Første begivenheder (N) |
Samlede begivenheder (N) |
Første begivenheder (N) |
Samlede begivenheder (N) |
| Enhver begivenhed | 572 | 900 | 514 | 803 |
| Dødelighed med al årsag | 122 | 186 | 110 | 177 |
| Ikke-dødelig MI | 118 | 157 | 105 | 131 |
| Slag | 96 | 119 | 76 | 92 |
| ACS | 63 | 78 | 42 | 65 |
| Hjerteindgreb | 101 | 240 | 101 | 195 |
| Major amputation af benene | 15 | 28 | 9 | 28 |
| Benrevaskularisering | 57 | 92 | 71 | 115 |
Der er også modtaget postmarketingrapporter om ny debut eller forværring af diabetisk makulær ødem med nedsat synsskarphed (se FORHOLDSREGLER, Generelt, Macular Ødem).
Laboratorie abnormiteter
Hæmatologisk: Actos kan forårsage fald i hæmoglobin og hæmatokrit. Faldet i hæmoglobin og hæmatokrit med Actos ser ud til at være dosisrelateret. I alle kliniske studier faldt de gennemsnitlige hæmoglobinværdier med 2% til 4% hos patienter behandlet med Actos. Disse ændringer forekom generelt i løbet af de første 4 til 12 uger af terapi og forblev relativt stabile derefter. Disse ændringer kan være relateret til øget plasmavolumen, der er forbundet med Actos-terapi, og har sjældent været forbundet med nogen betydelige hæmatologiske kliniske effekter.
Serumtransaminase-niveauer: I alle kliniske studier i USA havde 14 ud af 4780 (0,30%) patienter behandlet med Actos ALT-værdier - 3 gange den øvre normalgrænse under behandlingen. Alle patienter med opfølgningsværdier havde reversible forhøjelser i ALT. I populationen af patienter behandlet med Actos blev middelværdierne for bilirubin, AST, ALT, alkalisk phosphatase og GGT reduceret ved det sidste besøg sammenlignet med basislinien. Færre end 0,9% af patienterne behandlet med Actos blev trukket ud af kliniske forsøg i USA på grund af unormale leverfunktionstest.
I kliniske forsøg med godkendelse før var der ingen tilfælde af idiosynkratiske lægemiddelreaktioner, der førte til leversvigt (se FORHOLDSREGLER, Generelle, levereffekter).
CPK-niveauer: Under krævet laboratorieundersøgelse i kliniske forsøg blev sporadiske, kortvarige forhøjelser i kreatinphosphokinase-niveauer (CPK) observeret. En isoleret forhøjning til mere end 10 gange den øvre normalgrænse blev observeret hos 9 patienter (værdier fra 2150 til 11400 IE / L). Seks af disse patienter modtog fortsat Actos, to patienter havde afsluttet modtagerundersøgelsen medicin på tidspunktet for den forhøjede værdi, og en patient ophørte med studiemedicinen på grund af elevation. Disse forhøjninger opløst uden nogen tilsyneladende kliniske følger. Forholdet mellem disse begivenheder og Actos-terapi er ukendt.
top
Overdosis
Under kontrollerede kliniske forsøg blev der rapporteret om et tilfælde af overdosering med Actos. En mandlig patient tog 120 mg pr. Dag i fire dage og derefter 180 mg pr. Dag i syv dage. Patienten afviste kliniske symptomer i denne periode.
I tilfælde af overdosering skal passende understøttende behandling iværksættes i henhold til patientens kliniske tegn og symptomer.
top
Dosering og administration
Actos bør tages en gang dagligt uden hensyntagen til måltider.
Håndteringen af antidiabetisk behandling bør individualiseres. Ideelt set skal responset på terapi evalueres ved hjælp af HbA1c hvilket er en bedre indikator for langsigtet glykæmisk kontrol end FPG alene. HbA1c afspejler glykæmi i de sidste to til tre måneder. Ved klinisk brug anbefales det, at patienter behandles med Actos i et tidsrum, der er tilstrækkelige til at evaluere ændring i HbA1c (tre måneder), medmindre den glykæmiske kontrol forværres. Efter påbegyndelse af Actos eller med dosisforøgelse, skal patienter monitoreres omhyggeligt for bivirkninger relateret til væskeretention (se BOKSET ADVARSEL og ADVARSLER).
monoterapi
Actos monoterapi hos patienter, der ikke er tilstrækkeligt kontrolleret med diæt og motion, kan initieres med 15 mg eller 30 mg en gang dagligt. For patienter, der reagerer utilstrækkeligt på den første dosis af Actos, kan dosis øges i trin op til 45 mg en gang dagligt. For patienter, der ikke svarer tilstrækkeligt på monoterapi, bør kombinationsterapi overvejes.
Kombinationsterapi
Sulfonylurinstoffer: Actos i kombination med en sulfonylurinstof kan initieres med 15 mg eller 30 mg en gang dagligt. Den aktuelle dosis sulfonylurinstof kan fortsættes efter påbegyndelse af Actos-terapi. Hvis patienter rapporterer hypoglykæmi, skal dosis af sulfonylurinstof reduceres.
Metformin: Actos i kombination med metformin kan initieres med 15 mg eller 30 mg en gang dagligt. Den aktuelle metformindosis kan fortsættes efter påbegyndelse af Actos-terapi. Det er usandsynligt, at dosis metformin kræver justering på grund af hypoglykæmi under kombinationsbehandling med Actos.
Insulin: Actos i kombination med insulin kan initieres med 15 mg eller 30 mg en gang dagligt. Den aktuelle insulindosis kan fortsættes efter påbegyndelse af Actos-terapi. Hos patienter, der får Actos og insulin, kan insulindosis reduceres med 10% til 25%, hvis patienten rapporterer hypoglykæmi, eller hvis plasmaglukosekoncentration falder til under 100 mg / dL. Yderligere justeringer bør individualiseres baseret på glukosesænkende respons.
Maksimal anbefalet dosis
Dosen af Actos bør ikke overstige 45 mg en gang dagligt i monoterapi eller i kombination med sulfonylurinstof, metformin eller insulin.
Dosisjustering til patienter med nyreinsufficiens anbefales ikke (se KLINISK FARMAKOLOGIFarmakokinetik og stofmetabolisme).
Behandling med Actos bør ikke påbegyndes, hvis patienten udviser klinisk bevis for aktiv leversygdom eller øgede serumtransaminase niveauer (ALT større end 2,5 gange den øvre normalgrænse) ved behandlingsstart (se FORHOLDSREGLER, Generelle, levereffekter og KLINISK FARMAKOLOGI, Særlige befolkninger, leverinsufficiens). Leverenzymovervågning anbefales til alle patienter inden påbegyndelse af behandling med Actos og periodisk derefter (se FORHOLDSREGLER, Generelle, levereffekter).
Der findes ingen data om brugen af Actos til patienter under 18 år; derfor anbefales ikke brug af Actos til pædiatriske patienter.
Der findes ingen data om brugen af Actos i kombination med en anden thiazolidinedion.
top
Hvordan leveres
Actos fås i 15 mg, 30 mg og 45 mg tabletter som følger:
15 mg tablet: hvid til off-white, rund, konveks, ikke-scoret tablet med "Actos" på den ene side og "15" på den anden, tilgængelig i:
NDC 64764-151-04 Flasker på 30
NDC 64764-151-05 Flasker på 90
NDC 64764-151-06 Flasker på 500
30 mg tablet: hvid til off-white, rund, flad, ikke-scoret tablet med "Actos" på den ene side og "30" på den anden, tilgængelig i:
NDC 64764-301-14 Flasker på 30
NDC 64764-301-15 Flasker på 90
NDC 64764-301-16 Flasker på 500
45 mg tablet: hvid til off-white, rund, flad, ikke-scoret tablet med "Actos" på den ene side og "45" på den anden, tilgængelig i:
NDC 64764-451-24 Flasker på 30
NDC 64764-451-25 Flasker på 90
NDC 64764-451-26 Flasker på 500
OPBEVARING
Opbevares ved 25 ° C; udflugter tilladt til 15-30 ° C (59-86 ° F) [se USP kontrolleret rumtemperatur]. Hold beholderen tæt lukket og beskyt mod fugt og fugtighed.
top
Referencer
- Deng, LJ, et al. Virkning af gemfibrozil på farmakokinetikken af pioglitazon. Eur J Clin Pharmacol 2005; 61: 831-836, tabel 1.
2. Jaakkola, T, et al. Effekt af rifampicin på farmakokinetikken af pioglitazon. Clin Pharmacol Brit Jour 2006; 61:1 70-78.
Kun Rx
Fremstillet af:
Takeda Pharmaceutical Company Limited
Osaka, Japan
Markedsført af:
Takeda Pharmaceuticals America, Inc.
Én Takeda Parkway
Deerfield, IL 60015
Actos® er et registreret varemærke tilhørende Takeda Pharmaceutical Company Limited og brugt under licens af Takeda Pharmaceuticals America, Inc.
Alle andre varemærkenavne tilhører deres respektive ejere.
Sidst opdateret: 08/09
Actos, pioglitazone hcl, patientinformation (på almindeligt engelsk)
Detaljeret information om tegn, symptomer, årsager, behandling af diabetes
Oplysningerne i denne monografi er ikke beregnet til at dække alle mulige anvendelser, instruktioner, forholdsregler, medikamentinteraktion eller ugunstige virkninger. Denne information er generaliseret og er ikke beregnet til specifik medicinsk rådgivning. Hvis du har spørgsmål til de lægemidler, du tager eller ønsker flere oplysninger, skal du kontakte din læge, apotek eller sygeplejerske.
tilbage til: Gennemse alle medicin mod diabetes



