Glyset til behandling af diabetes
Brand Name: Glyset
Generisk navn: Miglitol
Indhold:
Beskrivelse
Klinisk farmakologi
Kliniske studier
Indikationer og anvendelse
Kontraindikationer
Forholdsregler
Bivirkninger
overdosering
Dosering og administration
Hvordan leveres
Glyset, miglitol, patientinformation (på almindeligt engelsk)
Beskrivelse
GLYSET-tabletter indeholder miglitol, en oral alpha-glucosidase-hæmmer til brug i behandlingen af ikke-insulinafhængig diabetes mellitus (NIDDM). Miglitol er et desoxynojirimycinderivat og er kemisk kendt som 3,4,5-piperidinetriol, 1- (2-hydroxyethyl) -2- (hydroxymethyl) -, [2R- (2Î ±, 3β, 4Î ±, 5β)] -. Det er et hvidt til bleggult pulver med en molekylvægt på 207,2. Miglitol er opløselig i vand og har en pKa på 5,9. Dets empiriske formel er C8H17NO5, og dens kemiske struktur er som følger:
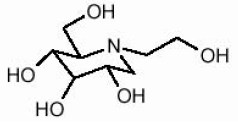
GLYSET fås som 25 mg, 50 mg og 100 mg tabletter til oral anvendelse. De inaktive ingredienser er stivelse, mikrokrystallinsk cellulose, magnesiumstearat, hypromellose, polyethylenglycol, titandioxid og polysorbat 80.
top
Klinisk farmakologi
Miglitol er et desoxynojirimycinderivat, der forsinker fordøjelsen af indtagne kulhydrater, hvilket resulterer i en mindre stigning i blodsukkerkoncentrationen efter måltider. Som en konsekvens af reduktion af plasmaglukose reducerer GLYSET tabletter niveauer af glycosyleret hæmoglobin hos patienter med type II (ikke-insulinafhængig) diabetes mellitus. Systemisk ikke-enzymatisk proteinglykosylering, som afspejles ved niveauer af glycosyleret hæmoglobin, er en funktion af den gennemsnitlige blodglukosekoncentration over tid.
Handlingsmekanisme
I modsætning til sulfonylurinstoffer forbedrer GLYSET ikke insulinudskillelsen. Den antihyperglykæmiske virkning af miglitol er resultatet af en reversibel inhibering af membranbundne tarm α ± -glucosidhydrolaseenzymer. Membranbundet tarm Î ± -glucosidaser hydrolyserer oligosaccharider og disaccharider til glukose og andre monosaccharider i børstet på tyndtarmen. Hos diabetespatienter resulterer denne enzyminhibering i forsinket glukoseabsorption og sænkning af postprandial hyperglycæmi.
Da dens virkningsmekanisme er forskellig, er effekten af GLYSET for at forbedre den glykæmiske kontrol additiv til sulfonylurinstoffer, når den anvendes i kombination. Derudover mindsker GLYSET de insulinotropiske og vægtforøgende virkninger af sulfonylurinstoffer.
Miglitol har mindre hæmmende aktivitet mod lactase, og i de anbefalede doser forventes det derfor ikke at inducere laktoseintolerance.
Farmakokinetik
absorption
Absorption af miglitol er mættelig ved høje doser: en dosis på 25 mg absorberes fuldstændigt, mens en dosis på 100 mg kun absorberes 50% - 70%. For alle doser nås maksimale koncentrationer på 2-3 timer. Der er ingen holdepunkter for, at systemisk absorption af miglitol bidrager til dens terapeutiske virkning.
Fordeling
Proteinbinding af miglitol er ubetydelig (<4,0%). Miglitol har et distributionsvolumen på 0,18 L / kg, hvilket er konsistent med distribution primært i den ekstracellulære væske.
Metabolisme
Miglitol metaboliseres ikke hos mennesker eller i nogen undersøgte dyrearter. Der er ikke påvist metabolitter i plasma, urin eller fæces, hvilket indikerer en mangel på systemisk eller præsystemisk metabolisme.
udskillelse
Miglitol elimineres ved renal udskillelse som uændret lægemiddel. Efter en dosis på 25 mg genvindes således over 95% af dosis i urinen inden for 24 timer. Ved højere doser er den kumulative genvinding af lægemiddel fra urinen noget lavere på grund af den ufuldstændige biotilgængelighed. Eliminationshalveringstiden for miglitol fra plasma er cirka 2 timer.
Særlige befolkninger
Nedsat nyrefunktion
Da miglitol udskilles primært med nyrerne, forventes ophobning af miglitol hos patienter med nedsat nyrefunktion. Patienter med kreatininclearance 60 ml / min. Dosisjustering for at korrigere de øgede plasmakoncentrationer er ikke mulig, fordi miglitol virker lokalt. Lidt information er tilgængelig om sikkerheden ved miglitol hos patienter med kreatininclearance <25 ml / min.
Nedsat leverfunktion
Farmakokinetikken for Miglitol blev ikke ændret hos cirrhotiske patienter i forhold til raske kontrolpersoner. Da miglitol ikke metaboliseres, forventes ingen påvirkning af leverfunktionen på kinlitikken i miglitol.
Køn
Der blev ikke observeret nogen signifikant forskel i farmakokinetikken for miglitol mellem ældre mænd og kvinder, når der blev taget hensyn til kropsvægt.
Race
Flere farmakokinetiske undersøgelser blev udført på japanske frivillige med resultater svarende til dem, der blev observeret hos kaukasiere. En undersøgelse, der sammenlignede det farmakodynamiske respons på en enkelt dosis på 50 mg hos sunde og hvide, sunde frivillige indikerede lignende glukose- og insulinrespons i begge populationer.
top
Kliniske studier
Klinisk erfaring med ikke-insulinafhængig diabetes mellitus (NIDDM) patienter kun til diætbehandling
GLYSET tabletter blev evalueret i to U.S. og tre ikke-U.S.-kontrollerede, faste doser, monoterapiundersøgelser, hvor 735 patienter behandlet med GLYSET blev evalueret til effektivitetsanalyser (se tabel 1).
I undersøgelse 1, et års undersøgelse, hvor GLYSET blev evalueret som monoterapi og også som kombinationsterapi, var der en statistisk signifikant mindre stigning i gennemsnitligt glycosyleret hæmoglobin (HbA1c) over tid i miglitol 50 mg 3 gange dagligt monoterapi-arm sammenlignet til placebo. Signifikante reduktioner i gennemsnitlig faste og postprandial plasmaglukoseniveau og i gennemsnitligt postprandial insulinniveauer blev observeret hos patienter behandlet med GLYSET sammenlignet med placebogruppen.
I undersøgelse 2, et 14-ugers studie, var der et signifikant fald i HbA1c hos patienter, der fik GLYSET 50 mg 3 gange dagligt eller 100 mg 3 gange dagligt sammenlignet med placebo. Derudover var der signifikante reduktioner i postprandial plasmaglukose og postprandial seruminsulinniveauer sammenlignet med placebo.
Undersøgelse 3 var et 6-måneders dosisrækkende forsøg, der vurderede GLYSET i doser fra 25 mg 3 gange dagligt til 200 mg 3 gange dagligt. GLYSET producerede en større reduktion i HbA1c end placebo i alle doser, skønt virkningen kun var statistisk signifikant ved 100 mg 3 gange dagligt og 200 mg 3 gange daglige doser. Derudover producerede alle doser af GLYSET signifikante reduktioner i postprandial plasmaglukose og postprandial insulinniveauer sammenlignet med placebo.
Undersøgelser 4 og 5 var 6-måneders studier, der evaluerede GLYSET henholdsvis 50 og 100 mg 3 gange dagligt og 100 mg 3 gange dagligt. Sammenlignet med placebo producerede GLYSET signifikante reduktioner i HbA1c såvel som en signifikant reduktion i postprandial plasmaglukose i begge undersøgelser i de anvendte doser.
Tabel 1 Resultater af monoterapiundersøgelse med Glyset
| Undersøgelse | Behandling | HbA1c (%) | 1 times postprandial glukose (mg / dL) | |
| Gennemsnitlig ændring fra baseline * | Behandlingseffekt ** | Gennemsnitlig ændring fra baseline | Behandlingseffekt ** | |
| 1 (U.S.) | Placebo | +0.71 | +24 | |
| GLYSET 50 mg t.i.d. *** | +0.13 | -0.58†| -39 | -63†|
| 2 (U.S.) | Placebo | +0.47 | +15 | |
| GLYSET 50 mg t.i.d. | -0.22 | -0.69†| -52 | -67†|
| GLYSET 100 mg t.i.d. | -0.28 | -0.75†| -59 | -74†|
| 3 (ikke-USA) | Placebo | +0.18 | +2 | |
| GLYSET 25 mg t.i.d. | -0.08 | -0.26 | -33 | -35†|
| GLYSET 50 mg t.i.d. | -0.22 | -0.40 | -45 | -47†|
| GLYSET 100 mg t.i.d. | -0.63 | -0.81†| -62 | -64†|
| GLYSET 200 mg t.i.d.c | -0.84 | -1.02†| -85 | -87†|
| 4 (ikke-USA) | Placebo | +0.01 | +8 | |
| GLYSET 50 mg t.i.d. | -0.35 | -0.36†| -20 | -28†|
| GLYSET 100 mg t.i.d. | -0.57 | -0.58†| -25 | -33†|
| 5 (ikke-USA) | Placebo | +0.32 | +17 | |
| GLYSET 100 mg t.i.d. | -0.43 | -0.75†| -38 | -55†|
| * Gennemsnitlig baseline varierede fra 7,54 til 8,72% i disse undersøgelser. ** Resultatet af subtraktion af placebogruppegennemsnittet. *** t.i.d. = 3 gange dagligt †p â ‰ ¤ 0,05 c Selvom resultater for 200 mg 3 gange dagligt præsenteres for fuldstændighed, er den maksimale anbefalede dosis af GLYSET 100 mg 3 gange dagligt. |
Klinisk erfaring med NIDDM-patienter, der modtager sulfonylurinstoffer
GLYSET blev undersøgt som supplerende behandling på baggrund af maksimal eller næsten maksimal sulfonylurinstof (SFU) -behandling i tre store, dobbeltblinde, randomiserede undersøgelser (to U.S. og en ikke U.S.), hvor 471 patienter behandlet med GLYSET blev evalueret for effektivitet (se Tabel 2).
Undersøgelse 6 inkluderede patienter under behandling med maksimale doser af SFU ved indrejse. Ved afslutningen af dette 14-ugers studie var de gennemsnitlige behandlingseffekter på glycosyleret hæmoglobin (HbA1c) -0,82% og -0,74% for patienter, der får GLYSET 50 mg 3 gange dagligt plus SFU, og GLYSET 100 mg 3 gange dagligt plus SFU, henholdsvis.
Undersøgelse 7 var et års undersøgelse, hvor GLYSET ved 25, 50 eller 100 mg 3 gange dagligt blev tilsat til en maksimal dosis glyburid (10 mg to gange dagligt). Ved afslutningen af denne undersøgelse blev de gennemsnitlige behandlingseffekter på HbA1c af GLYSET, når de tilsættes til maksimalt glyburid terapi var -0,30%, -0,62% og -0,73% med 25, 50 og 100 mg 3 gange daglige doser af GLYSET, henholdsvis.
I undersøgelse 8 frembragte tilsætning af GLYSET 100 mg 3 gange dagligt til en baggrund af behandling med glyburid en yderligere gennemsnitlig behandlingseffekt på HbA1c på -0,66%.
Tabel 2: Resultater af kombinationsterapi med GLYSET Plus Sulfonylurea (SFU)
| Undersøgelse | Behandling | HbA1c (%) | 1 times postprandial glukose (mg / dL) | |
| Gennemsnitlig ændring fra baseline * | Behandlingseffekt ** | Gennemsnitlig ændring fra baseline | Behandlingseffekt ** | |
| 6 (U.S.) | Placebo + SFU | +0.33 | -1 | |
| GLYSET 50 mg t.i.d. *** + SFU | -0.49 | -0.82†| -69 | -68†|
| GLYSET 100 mg t.i.d. + SFU | -0.41 | -0.74†| -73 | -72†|
| 7 (U.S.) | Placebo + SFU | +1.01 | 48 | |
| GLYSET 25 mg t.i.d. + SFU | +0.71 | -0.30 | -2 | -50†|
| GLYSET 50 mg t.i.d. + SFU | +0.39 | -0.62†| -13 | -61†|
| GLYSET 100 mg t.i.d. + SFU | +0.28 | -0.73†| -33 | -81†|
| 8 (ikke-USA) | Placebo + SFU | +0.16 | +10 | |
| GLYSET 100 mg t.i.d. + SFU | -0.50 | -0.66†| -36 | -46†|
| * Gennemsnitlig baseline varierede fra 8,56 til 9,16% i disse undersøgelser. ** Resultatet af subtraktion af placebogruppegennemsnittet. *** t.i.d. = 3 gange dagligt â € p â ‰ 0,05 |
Dosis-respons
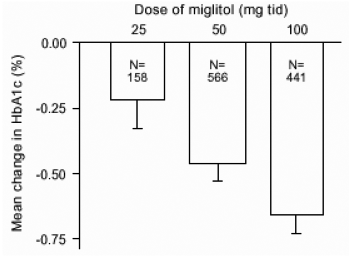
Resultater fra kontrollerede, faste dosisundersøgelser af Glyset som monoterapi eller som kombinationsbehandling med en sulfonylurinstof blev kombineret for at udlede et samlet estimat af forskellen fra placebo i den gennemsnitlige ændring fra basislinjen i glycosyleret hæmoglobin (HbA1c) og postprandial plasmaglukose som vist i figur 1 og 2:
Figur 1: HbA1c (%) Gennemsnitlig ændring fra basislinjen: Behandlingseffekt Samlede resultater fra kontrollerede faste doserundersøgelser i tabel 1 og 2
Figur 2: 1 times postprandial plasma-glukose Gennemsnitlig ændring fra basislinjen: Behandlingseffekt Samlede resultater fra kontrollerede faste doserundersøgelser i tabel 1 og 2
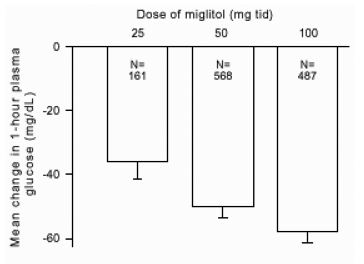
På grund af dens virkningsmekanisme manifesteres den primære farmakologiske virkning af miglitol som en reduktion i postprandial plasmaglukose, som tidligere vist i alle de store kliniske forsøg. GLYSET var statistisk signifikant forskellig fra placebo ved alle doser i hver af de individuelle studier med hensyn til effekt i gennemsnit en times postprandial plasmaglukose, og der er en dosisrespons fra 25 til 100 mg 3 gange dagligt for denne effekt parameter.
top
Indikationer og anvendelse
Glyset tabletter, som monoterapi, er indikeret som et supplement til diæt for at forbedre den glykæmiske kontrol i patienter med ikke-insulinafhængig diabetes mellitus (NIDDM), hvis hyperglykæmi ikke kan håndteres med diæt alene. Glyset kan også bruges i kombination med et sulfonylurinstof, når diæt plus enten Glyset eller et sulfonylurinstof alene ikke resulterer i tilstrækkelig glykæmisk kontrol. Virkningen af Glyset til at forstærke den glykæmiske kontrol er additiv til sulfonylurinstoffers virkning, når den anvendes i kombination, formodentlig fordi dens virkningsmekanisme er anderledes.
Ved påbegyndelse af behandling for NIDDM skal kost understreges som den primære behandlingsform. Kaloribegrænsning og vægttab er væsentlig hos den overvægtige diabetespatient. Korrekt diætstyring alene kan være effektiv til at kontrollere blodsukker og symptomer på hyperglykæmi. Betydningen af regelmæssig fysisk aktivitet, når det er relevant, bør også understreges. Hvis dette behandlingsprogram ikke resulterer i tilstrækkelig glykæmisk kontrol, bør brugen af Glyset overvejes. Brugen af Glyset skal ses af både lægen og patienten som en behandling ud over diæt og ikke som en erstatning for diæt eller som en praktisk mekanisme til at undgå kosttilskud.
top
Kontraindikationer
GLYSET tabletter er kontraindiceret til patienter med:
- Diabetisk ketoacidose
- Inflammatorisk tarmsygdom, colonic ulceration eller delvis intestinal obstruktion og hos patienter, der er disponeret for intestinal obstruktion
- Kroniske tarmsygdomme forbundet med markante forstyrrelser i fordøjelsen eller absorptionen eller med tilstande, der kan forringes som følge af øget gasdannelse i tarmen
- Overfølsomhed over for lægemidlet eller en af dets bestanddele.
top
Forholdsregler
Generel
hypoglykæmi
På grund af dens virkningsmekanisme bør GLYSET, når det administreres alene, ikke forårsage hypoglykæmi i fastende eller postprandial tilstand. Sulfonylurinstoffer kan forårsage hypoglykæmi. Da GLYSET tabletter, der gives i kombination med en sulfonylurinstof, vil medføre en yderligere sænkning af blodsukkeret, det kan øge det hypoglykæmiske potentiale for sulfonylurinstoffet, selvom dette ikke blev observeret i klinisk forsøg. Oral glukose (dextrose), hvis absorption ikke er forsinket med GLYSET, bør anvendes i stedet for saccharose (rørsukker) til behandling af mild til moderat hypoglykæmi. Sucrose, hvis hydrolyse til glukose og fruktose er inhiberet af GLYSET, er uegnet til hurtig korrektion af hypoglykæmi. Alvorlig hypoglykæmi kan kræve anvendelse af enten intravenøs glukoseinfusion eller glukagoninjektion.
Tab af kontrol med blodsukker
Når diabetespatienter udsættes for stress som feber, traumer, infektion eller operation, kan et midlertidigt tab af kontrol med blodsukkeret forekomme. På sådanne tidspunkter kan midlertidig insulinbehandling være nødvendig.
Nedsat nyrefunktion
Plasmakoncentrationer af GLYSET hos nyresvækkede frivillige blev forholdsmæssigt forøget i forhold til graden af nedsat nyrefunktion. Der er ikke udført langvarige kliniske forsøg hos diabetespatienter med signifikant nyrefunktion (serumkreatinin> 2,0 mg / dL). Derfor anbefales behandling af disse patienter med GLYSET ikke.
Oplysninger til patienter
Følgende information skal gives til patienter:
- Glyset bør tages oralt tre gange om dagen ved starten (med den første bid) af hvert hovedmåltid. Det er vigtigt at fortsætte med at overholde diætinstruktioner, et regelmæssigt træningsprogram og regelmæssig test af urin og / eller blodsukker.
- Glyset i sig selv forårsager ikke hypoglykæmi, selv når det administreres til patienter i fastende tilstand. Sulfonylurea-lægemidler og insulin kan imidlertid sænke blodsukkerniveauet nok til at forårsage symptomer eller undertiden livstruende hypoglykæmi. Fordi Glyset givet i kombination med en sulfonylurinstof eller insulin vil medføre en yderligere sænkning af blodsukkeret, kan det øge det hypoglykæmiske potentiale hos disse midler. Risikoen for hypoglykæmi, dens symptomer og behandling og tilstande, der disponerer for dens udvikling, skal forstås af patienter og ansvarlige familiemedlemmer. Da Glyset forhindrer nedbrydning af bordsukker, bør en kilde til glukose (dextrose, D-glucose) være let tilgængelig til behandling af symptomer på lavt blodsukker, når du tager Glyset i kombination med en sulfonylurinstof eller insulin.
- Hvis der opstår bivirkninger ved Glyset, udvikler de sig normalt i de første par uger af behandlingen. De er oftest milde til moderate dosisrelaterede mave-tarmvirkninger, såsom flatulens, bløde afføring, diarré eller ubehag i maven, og de formindskes generelt i frekvens og intensitet med tid. Afbrydelse af medikament resulterer normalt i hurtig opløsning af disse gastrointestinale symptomer.
Laboratorietest
Terapeutisk respons på GLYSET kan overvåges ved periodiske blodsukkertest. Måling af glycosyleret hæmoglobinniveauer anbefales til overvågning af langsigtet glykæmisk kontrol.
Hos 12 raske mænd påvirkede samtidig antacida samtidig ikke farmakokinetikken for miglitol.
Lægemiddelinteraktioner
Flere undersøgelser undersøgte den mulige interaktion mellem miglitol og glyburid. Hos seks raske frivillige fik en enkelt dosis 5 mg glyburid på baggrund af 6 dages behandling med miglitol (50 mg 3 gange dagligt i 4 dage efterfulgt af 100 mg 3 gange dagligt i 2 dage) eller placebo, middelværdien Cmax og AUC-værdier for glyburid var henholdsvis 17% og 25% lavere, når glyburid blev givet med miglitol. I en undersøgelse med diabetespatienter, hvor virkningen af at tilføje miglitol 100 mg 3 gange dagligt 7 dage eller placebo til en baggrundskontrol af 3,5 mg glyburid dagligt blev undersøgt, den gennemsnitlige AUC-værdi for glyburid var 18% lavere i gruppen behandlet med miglitol, skønt denne forskel ikke var statistisk væsentlig. Yderligere information om en potentiel interaktion med glyburid blev opnået fra en af de store amerikanske kliniske forsøg (Undersøgelse 7), hvor patienter fik dosering med enten miglitol eller placebo på en baggrund af 10 mg glyburid to gange dagligt. Ved 6-måneders og 1-årigt klinikbesøg udviste patienter, der tog samtidig miglitol 100 mg 3 gange dagligt, gennemsnitligt Cmax værdier for glyburid, der var henholdsvis 16% og 8% lavere sammenlignet med patienter, der tog glyburid alene. Disse forskelle var imidlertid ikke statistisk signifikante. Selv om der således var en tendens mod lavere AUC og Cmax værdier for glyburid, når det administreres sammen med Glyset, kan der ikke afgives nogen endelig erklæring vedrørende en potentiel interaktion baseret på de foregående tre undersøgelser.
Virkningen af miglitol (100 mg 3 gange dagligt â 7 dage) på farmakokinetikken af en enkelt 1000 mg dosis metformin blev undersøgt hos raske frivillige. Gennemsnitlig AUC og Cmax værdier for metformin var 12% til 13% lavere, når de frivillige fik miglitol sammenlignet med placebo, men denne forskel var ikke statistisk signifikant.
I en sund frivilligundersøgelse, samtidig administration af 50 mg eller 100 mg miglitol 3 gange dagligt sammen med digoxin reducerede de gennemsnitlige plasmakoncentrationer af digoxin med 19% og 28%, henholdsvis. Hos diabetespatienter under behandling med digoxin blev plasma-digoxinkoncentrationerne imidlertid ikke ændret ved samtidig administration af miglitol 100 mg 3 gange dagligt - 14 dage.
Andre sunde frivillige undersøgelser har vist, at miglitol kan reducere biotilgængeligheden af ranitidin og propranolol signifikant med henholdsvis 60% og 40%. Hverken warfarins eller nifedipins farmakokinetik eller farmakodynamik blev observeret.
Intestinal adsorbenter (f.eks. Trækul) og fordøjelsesenzymspræparater indeholdende kulhydratopdelende enzymer (f.eks. amylase, pancreatin) kan reducere effekten af Glyset og bør ikke tages samtidig.
Hos 12 raske mænd påvirkede samtidig antacida samtidig ikke farmakokinetikken for miglitol.
Karcinogenese, mutagenese og forringelse af fertilitet
Miglitol blev administreret til mus i diætruten i doser op til ca. 500 mg / kg kropsvægt (svarende til mere end 5 gange eksponeringen hos mennesker baseret på AUC) i 21 måneder. I et to-årigt rottestudie blev miglitol administreret i kosten ved eksponeringer, der var sammenlignelige med de maksimale humane eksponeringer baseret på AUC. Der var ingen tegn på kræftfremkaldende virkning som følge af diætbehandling med miglitol.
In vitro blev miglitol fundet ikke-mutagent ved bakteriemutagenese-analysen (Ames) -assayet og det eukaryotiske fremadmutationsassay (CHO / HGPRT). Miglitol havde ingen clastogene virkninger in vivo i mikronukleustesten. Der blev ikke påvist arvelige mutationer ved dominerende dødelig assay.
En kombineret mandlig og kvindelig fertilitetsundersøgelse udført i Wistar-rotter behandlet oralt med miglitol i dosisniveauer på 300 mg / kg kropsvægt (ca. 8 gange den maksimale menneskelige eksponering baseret på kropsoverfladeareal) frembragte ingen uhensigtsmæssig effekt på reproduktionsevne eller evne at gengive. Derudover blev afkomens overlevelse, vækst, udvikling og fertilitet ikke kompromitteret.
Graviditet
Teratogene effekter
Graviditet kategori B
Sikkerheden ved GLYSET hos gravide er ikke fastlagt. Udviklings toksikologiske undersøgelser er blevet udført på rotter i doser på 50, 150 og 450 mg / kg, tilsvarende til niveauer på ca. 1,5, 4 og 12 gange den maksimale anbefalede eksponering for mennesker baseret på kropsoverfladen areal. Hos kaniner blev doser på 10, 45 og 200 mg / kg svarende til niveauer på ca. 0,5, 3 og 10 gange den menneskelige eksponering undersøgt. Disse studier afslørede ingen tegn på føtal misdannelser, der kunne tilskrives miglitol. Doser af miglitol op til 4 og 3 gange den humane dosis (baseret på kropsoverfladeareal) til henholdsvis rotter og kaniner afslørede ikke tegn på nedsat fertilitet eller skade på fosteret. De højeste doser, der blev testet i disse undersøgelser, 450 mg / kg hos rotten og 200 mg / kg hos kanin fremmet mødre og / eller føtal toksicitet. Fetotoksicitet blev indikeret ved en lille men signifikant reduktion i føtalets vægt i rotteundersøgelsen og let reduktion i fostervægt, forsinket ossificering af fosterets skelet og stigning i procentdelen af ikke-levedygtige fostre i kaninen undersøgelse. I det peri-postnatal studie på rotter var NOAEL (ingen observeret bivirkningsniveau) 100 mg / kg (svarende til cirka fire gange eksponeringen for mennesker, baseret på kropsoverfladeareal). En stigning i dødfødt afkom blev observeret ved den høje dosis (300 mg / kg) i rotter peri-postnatal undersøgelse, men ikke ved den høje dosis (450 mg / kg) i leveringssegmentet for rotteudviklingstoksicitet undersøgelse. Ellers var der ingen bivirkning på overlevelse, vækst, udvikling, adfærd eller fertilitet i hverken rotteudviklingstoksicitet eller peri-postnatal undersøgelser. Der er dog ingen passende og velkontrollerede studier på gravide kvinder. Da dyrefortplantningsundersøgelser ikke altid er forudsigelige for menneskelig respons, bør dette lægemiddel kun bruges under graviditet, hvis det er klart nødvendigt.
Sygeplejerske mødre
Det har vist sig, at Miglitol udskilles i modermælk i meget lille grad. Total udskillelse i mælk tegnede sig for 0,02% af en 100 mg moderdosis. Den anslåede eksponering for et ammende spædbarn er ca. 0,4% af moderens dosis. Selvom niveauerne af miglitol nået i modermælk er meget lave, anbefales det, at GLYSET ikke administreres til en ammende kvinde.
Pædiatrisk brug
Sikkerhed og effektivitet af GLYSET hos pædiatriske patienter er ikke fastlagt.
Geriatrisk brug
Af det samlede antal forsøgspersoner i kliniske studier af GLYSET i USA omfattede patienter, der var gyldige til sikkerhedsanalyser, 24% over 65 og 3% over 75. Ingen generelle forskelle i sikkerhed og effektivitet blev observeret mellem disse forsøgspersoner og yngre personer. Farmakokinetikken for miglitol blev undersøgt hos ældre og unge mænd (n = 8 pr. Gruppe). Ved doseringen på 100 mg 3 gange dagligt i 3 dage blev der ikke fundet nogen forskelle mellem de to grupper.
top
Bivirkninger
Mave
Gastrointestinale symptomer er de mest almindelige reaktioner på GLYSET tabletter. I U.S. placebo-kontrollerede forsøg var forekomsten af mavesmerter, diarré og flatulens henholdsvis 11,7%, 28,7% og 41,5% i 962 patienter behandlet med GLYSET 25-100 mg 3 gange dagligt, hvorimod de tilsvarende forekomster var 4,7%, 10,0% og 12,0% i 603 placebo-behandlede patienter. Forekomsten af diarré og mavesmerter havde en tendens til at aftage betydeligt ved fortsat behandling.
dermatologisk
Der blev rapporteret hududslæt hos 4,3% af patienterne behandlet med GLYSET sammenlignet med 2,4% af de placebo-behandlede patienter. Udslæt var generelt forbigående, og de fleste blev vurderet som ikke-relateret til GLYSET af læge-efterforskere.
Unormale laboratoriefund
Jern med lavt serum forekom hyppigere hos patienter behandlet med GLYSET (9,2%) end hos placebo-behandlede patienter (4,2%), men gjorde ikke fortsætter i de fleste tilfælde og var ikke forbundet med reduktion i hæmoglobin eller ændringer i andre hæmatologiske indekser.
top
overdosering
I modsætning til sulfonylurinstoffer eller insulin, vil en overdosis af GLYSET tabletter ikke resultere i hypoglykæmi. En overdosis kan resultere i kortvarige stigninger i flatulens, diarré og ubehag i maven. På grund af den manglende ekstra-intestinale virkning, der ses ved GLYSET, forventes ingen alvorlige systemiske reaktioner i tilfælde af en overdosering.
top
Dosering og administration
Der er ingen fast doseringsregime til behandling af diabetes mellitus med GLYSET tabletter eller andre farmakologiske midler. Dosering af GLYSET skal individualiseres på grundlag af både effektivitet og tolerance, mens den maksimale anbefalede dosis på 100 mg ikke overskrides 3 gange dagligt. GLYSET skal tages tre gange dagligt ved starten (med den første bid) af hvert hovedmåltid. GLYSET skal startes med 25 mg, og doseringen øges gradvist som beskrevet nedenfor, begge for at reducere gastrointestinale bivirkninger og for at tillade identifikation af den minimale dosis, der kræves for tilstrækkelig glykæmisk kontrol af patienten.
Under behandlingsstart og dosis-titrering (se nedenfor) kan en times postprandial plasmaglukose være bruges til at bestemme det terapeutiske respons på GLYSET og identificere den minimale effektive dosis til patient. Derefter skal glycosyleret hæmoglobin måles med intervaller på cirka tre måneder. Det terapeutiske mål bør være at reducere både postprandial plasmaglukose og glycosyleret hæmoglobinniveau til normalt eller næsten normalt ved at bruge den laveste effektive dosis af GLYSET, enten som monoterapi eller i kombination med en sulfonylurinstof.
Startdosering
Den anbefalede startdosis af GLYSET er 25 mg, gives oralt tre gange dagligt ved starten (med den første bid) af hvert hovedmåltid. Nogle patienter kan dog have fordel ved at starte med 25 mg en gang dagligt for at minimere bivirkninger i mave-tarmkanalen og gradvist øge indgivelsesfrekvensen til 3 gange dagligt.
Vedligeholdelsesdosering
Den sædvanlige vedligeholdelsesdosis af GLYSET er 50 mg 3 gange dagligt, selvom nogle patienter kan have fordel af at øge dosis til 100 mg 3 gange dagligt. For at tillade tilpasning til potentielle gastrointestinale bivirkninger anbefales det, at GLYSET-behandling foretages initieret i en dosis på 25 mg 3 gange dagligt, den laveste effektive dosis, og derefter gradvist titreret opad for at tillade tilpasning. Efter 4 - 8 uger af den 25 mg 3 gange daglige behandling, bør dosis øges til 50 mg 3 gange dagligt for cirka tre måneder, hvorefter et glycosyleret hæmoglobinniveau skal måles for at vurdere det terapeutiske respons. Hvis det glycosylerede hæmoglobinniveau på det tidspunkt ikke er tilfredsstillende, kan doseringen øges yderligere til 100 mg 3 gange dagligt, den maksimale anbefalede dosis. Samlede data fra kontrollerede studier antyder en dosisrespons for både HbA1c og en times postprandial plasmaglukose i det anbefalede dosisområde. Imidlertid har ingen enkelt undersøgelse undersøgt virkningen på glykæmisk kontrol af titrerende patienters doser opad i den samme undersøgelse. Hvis der ikke observeres yderligere reduktion i postprandial glukose eller glycosyleret hæmoglobinniveauer med titrering til 100 mg 3 gange dagligt, bør det overvejes at sænke dosis. Når en effektiv og tolereret dosis er etableret, skal den opretholdes.
Maksimal dosering
Den maksimale anbefalede dosis af GLYSET er 100 mg 3 gange dagligt. I et klinisk forsøg gav 200 mg 3 gange dagligt yderligere forbedret glykæmisk kontrol, men øgede forekomsten af gastrointestinale symptomer beskrevet ovenfor.
Patienter, der modtager sulfonylurinstoffer
Sulfonylurinstoffer kan forårsage hypoglykæmi. Der var ingen øget forekomst af hypoglykæmi hos patienter, der tog GLYSET i kombination med sulfonylurinstof agenser sammenlignet med forekomsten af hypoglykæmi hos patienter, der kun fik sulfonylurinstoffer i enhver klinisk forsøg.
GLYSET, der gives i kombination med en sulfonylurinstof, vil imidlertid medføre en yderligere sænkning af blodglukose og kan øge risikoen for hypoglykæmi på grund af de to agens additive effekter. Hvis der opstår hypoglykæmi, skal passende justeringer af dosis af disse midler foretages.
top
Hvordan leveres
GLYSET tabletter fås som 25 mg, 50 mg og 100 mg hvide, runde, filmovertrukne tabletter. Tablettene er præget med ordet "GLYSET" på den ene side og styrken på den anden side, som angivet nedenfor.
| Styrke | NDC | Tablet-identifikation | |
| Foran | Tilbage | ||
| Flasker på 100: | |||
| 25 mg | 0009-5012-01 | GLYSET | 25 |
| 50 mg | 0009-5013-01 | GLYSET | 50 |
| 100 mg | 0009-5014-01 | GLYSET | 100 |
Opbevares ved 25 ° C; udflugter tilladt til 15 ° -30 ° C (59 ° -86 ° F) [se USP kontrolleret rumtemperatur].
Kun Rx

Fremstillet af:
Bayer HealthCare AG
Leverkusen, Tyskland
Glyset er et registreret varemærke tilhørende Bayer HealthCare Pharmaceuticals Inc brugt under licens.
LAB-0167 til 6,0
sidst opdateret 05/2008
Glyset, miglitol, patientinformation (på almindeligt engelsk)
Detaljeret information om tegn, symptomer, årsager, behandling af diabetes
Oplysningerne i denne monografi er ikke beregnet til at dække alle mulige anvendelser, retninger, forholdsregler, medikamentinteraktion eller ugunstige virkninger. Denne information er generaliseret og er ikke beregnet til specifik medicinsk rådgivning. Hvis du har spørgsmål om de medicin, du tager eller ønsker mere information, skal du kontakte din læge, apotek eller sygeplejerske.
tilbage til: Gennemse alle medicin mod diabetes



