Provigil: Behandling for vågenhed (Fuld receptinformation)
Brand name: Provigil
Generisk navn: Modafinil
Indhold:
Beskrivelse
Farmakologi
Kliniske spor
Indikationer og anvendelse
Kontraindikationer
Advarsler
Forholdsregler
Bivirkninger
Narkotikamisbrug og afhængighed
overdosering
Dosering og administration
Hvordan leveres
Provigil (modafinil) patientinformationsark (på almindeligt engelsk)
Beskrivelse
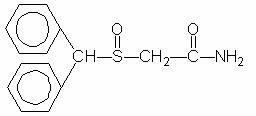
Provigil (modafinil) er et vågentøjsfremmende middel til oral administration. Modafinil er en racemisk forbindelse. Det kemiske navn for modafinil er 2 - [(diphenylmethyl) sulfinyl] acetamid. Molekylformlen er C15H15NO2S, og molekylvægten er 273,35.
Den kemiske struktur er:
Modafinil er et hvidt til off-white, krystallinsk pulver, der er praktisk talt uopløseligt i vand og cyclohexan. Det er sparsomt til let opløseligt i methanol og acetone. Provigil-tabletter indeholder 100 mg eller 200 mg modafinil og følgende inaktive ingredienser: lactose, mikrokrystallinsk cellulose, forgelatineret stivelse, croscarmellosenatrium, povidon og magnesium stearat.
top
Klinisk farmakologi
Handlingsmekanisme og farmakologi
Den nøjagtige mekanisme (r), gennem hvilke modafinil fremmer vågenthed er ukendt. Modafinil har vågne-fremmende virkninger, der ligner sympatomimetiske midler som amfetamin og methylphenidat, skønt den farmakologiske profil ikke er identisk med den for sympatomimetiske aminer.
Modafinil har svage til ubetydelige interaktioner med receptorer for noradrenalin, serotonin, dopamin, GABA, adenosin, histamin-3, melatonin og benzodiazepiner. Modafinil hæmmer heller ikke aktiviteterne fra MAO-B eller phosphodiesteraser II-V.
Modafinil-induceret vågenhed kan dæmpes af Î ± 1-adrenerg receptorantagonist-prazosin; modafinil er imidlertid inaktiv i andre in vitro-assaysystemer, der vides at være responsive over for ± ± adrenerge agonister, såsom rotte vas deferens-præparat.
Modafinil er ikke en direkte eller indirekte virkende dopaminreceptoragonist. In vitro binder modafinil imidlertid til dopamintransportøren og hæmmer genoptagelse af dopamin. Denne aktivitet er blevet forbundet in vivo med forøgede ekstracellulære dopaminniveauer i nogle hjerneregioner hos dyr. Hos genetisk manipulerede mus, der manglede dopamintransportøren (DAT), manglede modafinil vågnefremmende aktivitet, hvilket antydede, at denne aktivitet var DAT-afhængig. Imidlertid blev de vågne-fremmende virkninger af modafinil, i modsætning til amfetamin, ikke antagoniseret af dopaminreceptorantagonisten haloperidol i rotter. Derudover blokerer alpha-methyl-p-tyrosin, en dopaminsynteseinhibitor, virkningen af amfetamin, men blokerer ikke for lokomotorisk aktivitet induceret af modafinil.
Hos katten øgede lige vågenthedsfremmende doser af methylphenidat og amfetamin neuronal aktivering i hele hjernen. Modafinil ved en ækvivalent ækvivalensfremmende dosis øgede selektivt og markant neuronal aktivering i mere diskrete områder af hjernen. Forholdet mellem dette fund hos katte og virkningerne af modafinil hos mennesker er ukendt.
Ud over dets vågnefremmende virkninger og evnen til at øge den lokomotoriske aktivitet hos dyr producerer modafinil psykoaktive og euforiske effekter, ændringer i humør, opfattelse, tænkning og følelser typiske for andre CNS-stimulanter hos mennesker. Modafinil har forstærkende egenskaber, som det fremgår af dets selvadministration hos aber, der tidligere er trænet til selvadministrering af kokain. Modafinil blev også delvist diskrimineret som stimulerende.
De optiske enantiomerer af modafinil har lignende farmakologiske virkninger hos dyr. To vigtigste metabolitter af modafinil, modafinil syre og modafinil sulfon, ser ikke ud til at bidrage til modafinils CNS-aktiverende egenskaber.
Farmakokinetik
Modafinil er en racemisk forbindelse, hvis enantiomerer har forskellig farmakokinetik (for eksempel er halveringstiden for l-isomeren ca. tre gange den for d-isomeren hos voksne mennesker). Enantiomererne konverterer ikke. Ved stabil tilstand er den samlede eksponering for l-isomeren cirka tre gange den for d-isomeren. Trugkoncentrationen (Cminss) af cirkulerende modafinil efter dosering en gang dagligt består af 90% af l-isomeren og 10% af d-isomeren. Den effektive eliminationshalveringstid for modafinil efter flere doser er ca. 15 timer. Enantiomererne af modafinil udviser lineær kinetik efter multiple doseringer på 200-600 mg / dag en gang dagligt hos raske frivillige. Tilsyneladende stabile tilstande med total modafinil og l - (-) - modafinil nås efter 2-4 dages dosering.
absorption
Absorption af Provigil tabletter er hurtig, med maksimale plasmakoncentrationer, der forekommer 2-4 timer. Biotilgængeligheden af Provigil-tabletter er omtrent lig med en vandig suspension. Den absolutte orale biotilgængelighed blev ikke bestemt på grund af den vandige uopløselighed (<1 mg / ml) af modafinil, hvilket udelukkede intravenøs indgivelse. Mad har ingen indflydelse på den generelle biotilgængelighed af Provigil; dens absorption (tmax) kan blive forsinket med cirka en time, hvis det tages sammen med mad.
Fordeling
Modafinil er godt fordelt i kropsvæv med et tilsyneladende distributionsvolumen (~ 0,9 L / kg) større end volumenet af det samlede kropsvand (0,6 L / kg). I humant plasma in vitro er modafinil moderat bundet til plasmaprotein (~ 60%, hovedsageligt til albumin). Ved serumkoncentrationer opnået i stabil tilstand efter doser på 200 mg / dag udviser modafinil ingen forskydning af proteinbinding af warfarin, diazepam eller propranolol. Selv ved meget større koncentrationer (1000 uM; > 25 gange Cmax på 40 uM ved stabil tilstand ved 400 mg / dag) har modafinil ingen virkning på warfarinbinding. Modafinil syre ved koncentrationer> 500 uM nedsætter graden af warfarinbinding, men disse koncentrationer er> 35 gange de, der opnås terapeutisk.
Metabolisme og eliminering
Den største eliminationsvej er metabolisme (~ 90%), primært af leveren, med efterfølgende renal eliminering af metabolitterne. Uralalkalinisering har ingen virkning på eliminering af modafinil.
Metabolisme forekommer gennem hydrolytisk deamidering, S-oxidation, aromatisk ringhydroxylering og glukuronidkonjugering. Mindre end 10% af en administreret dosis udskilles som modersubstansen. I en klinisk undersøgelse ved anvendelse af radiomærket modafinil blev i alt 81% af den indgivne radioaktivitet genvundet i 11 dage efter dosis, overvejende i urinen (80% vs. 1,0% i fæces). Den største fraktion af lægemidlet i urinen var modafinil syre, men mindst seks andre metabolitter var til stede i lavere koncentrationer. Kun to metabolitter når mærkbare koncentrationer i plasma, dvs. modafinilsyre og modafinilsulfon. I prækliniske modeller var modafinil syre, modafinil sulfon, 2 - [(diphenylmethyl) sulfonyl] eddikesyre og 4-hydroxy modafinil inaktive eller syntes ikke at formidle modvirkningseffekten af modafinil.
Hos voksne er der undertiden observeret fald i trough-niveauer af modafinil efter flere ugers dosering, hvilket antyder autoinduktion, men størrelsen af faldene og inkonsekvensen af deres forekomst antyder, at deres kliniske betydning er minimal. Der er observeret betydelig akkumulering af modafinil sulfon efter flere doser på grund af dets lange eliminationshalveringstid på 40 timer. Induktion af metaboliserende enzymer, vigtigst af cytochrome P-450 (CYP) 3A4, er også blevet observeret in vitro efter inkubation af primære kulturer af humane hepatocytter med modafinil og in vivo efter udvidet administration af modafinil ved 400 mg / dag. (For yderligere diskussion af virkningerne af modafinil på CYP-enzymaktiviteter, se FORHOLDSREGLER, Lægemiddelinteraktioner.)
Drug-Drug Interactions:
Baseret på in vitro-data metaboliseres modafinil delvist af 3A-isoformsubfamilien af levercytochrom P450 (CYP3A4). Derudover har modafinil potentialet til at hæmme CYP2C19, undertrykke CYP2C9 og inducere CYP3A4, CYP2B6 og CYP1A2. Da modafinil og modafinil sulfone er reversible hæmmere af det lægemiddelmetaboliserende enzym CYP2C19, skal administration af modafinil sammen med lægemidler såsom diazepam, phenytoin og propranolol, som i vid udstrækning elimineres via denne vej, kan øge cirkulationsniveauerne for disse forbindelser. Derudover hos personer, der er mangelfulde i enzymet CYP2D6 (dvs. 7-10% af den kaukasiske befolkning; niveauer af CYP2D6-underlag såsom tricykliske antidepressiva og selektiv serotonin genoptagelsesinhibitorer, der har tilknyttede eliminationsveje gennem CYP2C19, kan øges ved samtidig administration af modafinil. Dosisjusteringer kan være nødvendige for patienter, der behandles med disse og lignende medicin (se FORHOLDSREGLER, Lægemiddelinteraktioner). Et in vitro-studie viste, at armodafinil (en af enantiomererne af modafinil) er et substrat af P-glycoprotein.
Samtidig indgivelse af modafinil med andre CNS-aktive lægemidler, såsom methylphenidat og dextroamphetamin, ændrede ikke farmakokinetikken for et hvilket som helst lægemiddel.
Kronisk administration af modafinil 400 mg viste sig at reducere den systemiske eksponering for to CYP3A4 substrater, ethinyløstradiol og triazolam efter oral indgivelse, hvilket antyder, at CYP3A4 havde været induceret. Kronisk indgivelse af modafinil kan øge eliminationen af substrater af CYP3A4. Dosisjusteringer kan være nødvendige for patienter, der behandles med disse og lignende medicin (se FORHOLDSREGLER, Lægemiddelinteraktioner).
En tilsyneladende koncentrationsrelateret undertrykkelse af CYP2C9-aktivitet blev observeret i humane hepatocytter efter eksponering for modafinil in vitro hvilket antyder, at der er et potentiale for en metabolisk interaktion mellem modafinil og substraterne i dette enzym (f.eks. S-warfarin, phenytoin). I en interaktionsundersøgelse hos raske frivillige viste imidlertid kronisk modafinilbehandling ikke nogen signifikant effekt på farmakokinetikken for warfarin sammenlignet med placebo. (Se FORHOLDSREGLER, Lægemiddelinteraktioner, andre stoffer, Warfarin).
Særlige befolkninger
Kønnseffekt:
Modafinils farmakokinetik påvirkes ikke af køn.
Alderseffekt:
Et let fald (~ 20%) i den orale clearance (CL / F) af modafinil blev observeret i en enkeltdosisundersøgelse ved 200 mg i 12 individer med en gennemsnitlig alder på 63 år (område 53 - 72 år), men ændringen blev ikke vurderet at være klinisk væsentlig. I en undersøgelse med flere doser (300 mg / dag) hos 12 patienter med en middelalder på 82 år (spænding 67 - 87 år), var gennemsnittet niveauer af modafinil i plasma var cirka to gange det, der historisk blev opnået i matchet yngre emner. På grund af potentielle effekter fra de flere samtidige medicin, som de fleste af patienterne var sammen med behandlet kan den tilsyneladende forskel i farmakokinetik for modafinil muligvis ikke kun tilskrives virkningerne af aldring. Resultaterne antyder dog, at clearance af modafinil kan reduceres hos ældre (se Dosering og administration).
Race Effect:
Race's indflydelse på modafinils farmakokinetik er ikke undersøgt.
Nedsat nyrefunktion:
I en enkeltdosis 200 mg modafinil-undersøgelse gjorde alvorlig kronisk nyresvigt (kreatininclearance - 20 ml / min) ikke påvirkede farmakokinetikken af modafinil signifikant, men eksponeringen for modafinil syre (en inaktiv metabolit) blev øget 9 gange (se FORHOLDSREGLER).
Nedsat leverfunktion:
Farmakokinetik og metabolisme blev undersøgt hos patienter med levercirrose (6 mænd og 3 kvinder). Tre patienter havde cirkel fase B eller B + cirrhose (ifølge Child-kriterierne) og 6 patienter havde fase C eller C + cirrhosis. Klinisk var 8 ud af 9 patienter icteriske og havde alle ascites. Hos disse patienter blev den orale clearance af modafinil reduceret med ca. 60%, og stabilitetskoncentrationen blev fordoblet sammenlignet med normale patienter. Dosen af Provigil bør reduceres hos patienter med svær leverinsufficiens (se pkt FORHOLDSREGLER og Dosering og administration).
top
Kliniske spor
Provigil's effektivitet til at reducere overdreven søvnighed er blevet fastlagt i følgende søvn lidelser: narkolepsi, obstruktiv søvnapnø / hypopnea syndrom (OSAHS) og skiftforstyrrelser i søvnforstyrrelser (SWSD).
Narkolepsi
Effektiviteten af Provigil til at reducere den overdreven søvnighed (ES), der er forbundet med narkolepsi, blev fastlagt i to amerikanske 9-uger, multicenter, placebokontrolleret, to-dosis (200 mg pr. dag og 400 mg pr. dag) parallel-gruppe, dobbeltblinde undersøgelser af ambulante patienter, der mødte ICD-9 og American Sleep Disorders Association kriterier for narkolepsi (som også er i overensstemmelse med American Psychiatric Association) DSM-IV-kriterier). Disse kriterier inkluderer enten 1) tilbagevendende lur på dagen eller bortfalder i søvn, der forekommer næsten dagligt i mindst tre måneder, plus pludseligt bilateralt tab af postural muskel tone i forbindelse med intens følelse (kataplexi) eller 2) en klage over overdreven søvnighed eller pludselig muskelsvaghed med tilhørende træk: søvnlammelse, hypnagogisk hallucinationer, automatisk opførsel, forstyrret større søvn episode; og polysomnografi, der demonstrerer et af følgende: søvn latens mindre end 10 minutter eller hurtig øjenbevægelse (REM) søvn latens mindre end 20 minutter. Derudover krævedes det, at alle patienter objektivt havde dokumenteret overdreven søvnighed om dagen, en flere søvn Latency Test (MSLT) med to eller flere REM-perioder med søvnindtræden og fraværet af andre klinisk signifikante aktive medicinske eller psykiatriske sygdom. MSLT, en objektiv polysomnografisk vurdering om dagen af patientens evne til at falde i søvn i en ustimulerende miljø, måler latens (i minutter) til at begynde at sove gennemsnit i 4 testsessioner med 2 timers intervaller efter nat polysomnografi. For hver testsession fik faget besked om at ligge stille og forsøge at sove. Hver testsession blev afsluttet efter 20 minutter, hvis der ikke opstod søvn eller 15 minutter efter søvnens begyndelse.
I begge undersøgelser var de primære mål for effektivitet 1) søvnforsinkelse som vurderet ved hjælp af opretholdelse af vågenhedstest (MWT) og 2) ændringen i patientens samlede sygdomsstatus, målt ved det kliniske globale indtryk af ændring (CGI-C). For en vellykket forsøg måtte begge foranstaltninger vise en betydelig forbedring.
MWT måler latenstid (i minutter) til at begynde at sove gennemsnit i 4 testsessioner med 2 timers intervaller efter natlig polysomnografi. For hver testsession blev emnet bedt om at forsøge at forblive vågen uden at bruge ekstraordinære foranstaltninger. Hver testsession blev afsluttet efter 20 minutter, hvis der ikke forekom nogen søvn eller 10 minutter efter indtræden af søvn. CGI-C er en 7-punkts skala, der er centreret omkring Ingen ændring og spænder fra meget meget værre til meget forbedret. Patienter blev bedømt af evaluerere, der ikke havde adgang til data om patienterne andet end et mål for deres baseline-sværhedsgrad. Evaluerere fik ikke nogen specifik vejledning om de kriterier, de skulle anvende, når de bedømte patienter.
Andre vurderinger af virkning inkluderede Multiple Sleep Latency Test (MSLT), Epworth Sleepiness Scale (ESS; en række spørgsmål designet til at vurdere graden af søvnighed i daglige situationer) Steer Clear Performance Test (SCPT; en computerbaseret evaluering af en patients evne til at undgå at ramme forhindringer i en simuleret køresituation), standard natlig polysomnografi og patientens daglige søvnlog. Patienter blev også vurderet med skalaen Livskvalitet i narkolepsi (QOLIN), som indeholder det validerede SF-36-sundhedsspørgeskema.
Begge studier viste forbedring i objektive og subjektive mål for overdreven søvnighed om dagen for både 200 mg og 400 mg doser sammenlignet med placebo. Patienter behandlet med begge doser Provigil viste en statistisk signifikant forbedret evne til at forblive vågen på MWT (alle p-værdier <0,001) ved uger 3, 6, 9 og sidste besøg sammenlignet med placebo og en statistisk signifikant større global forbedring, vurderet efter CGI-C skalaen (alle p-værdier <0.05).
De gennemsnitlige søvnforsinkelser (i minutter) på MWT ved baseline for de 2 kontrollerede forsøg er vist i tabel 1 nedenfor sammen med den gennemsnitlige ændring fra basislinjen på MWT ved det sidste besøg.
Procentdelene af patienter, der viste en hvilken som helst grad af forbedring af CGI-C i de to kliniske forsøg, er vist i tabel 2 nedenfor.
Tilsvarende statistisk signifikante behandlingsrelaterede forbedringer blev set på andre mål for svækkelse i narkolepsi, inklusive en patient vurderet niveau af søvnighed om dagen på ESS (p <0,001 for hver dosis i sammenligning med placebo).
Nattsøvn målt med polysomnografi blev ikke påvirket af brugen af Provigil.
Obstruktiv søvnapnø / hypopneasyndrom (OSAHS)
Provigils effektivitet til at reducere den overdreven søvnighed, der er forbundet med OSAHS, blev fastlagt i to kliniske forsøg. I begge studier blev patienter tilmeldt, der opfyldte den internationale klassificering af søvnforstyrrelser (ICSD) kriterier for OSAHS (som også er i overensstemmelse med American Psychiatric Association DSM-IV kriterier). Disse kriterier inkluderer enten 1) overdreven søvnighed eller søvnløshed, plus hyppige episoder med nedsat funktion vejrtrækning under søvn, og tilknyttede funktioner såsom høj snorken, hovedpine om morgenen og tør mund efter opvågnen; eller 2) overdreven søvnighed eller søvnløshed og polysomnografi, der viser et af følgende: mere end fem obstruktive apnøer, hver mere end 10 sekunder i varighed, pr. time søvn og et eller flere af følgende: hyppige arousals fra søvn forbundet med apnøerne, bradytachycardia og arteriel ilt desaturation i forbindelse med apneas. Desuden krævede alle patienter for indrejse i disse undersøgelser at have overdreven søvnighed som vist med en score - 10 ¥ på Epworth Sleepiness Scale, på trods af behandling med kontinuerligt positivt luftvejstryk (CPAP). Bevis for, at CPAP var effektiv til at reducere episoder med apnø / hypopnea var påkrævet sammen med dokumentation af CPAP-anvendelse.
I den første undersøgelse, et 12-ugers placebo-kontrolleret multicenter-forsøg, blev i alt 327 patienter randomiseret til at modtage Provigil 200 mg / dag, Provigil 400 mg / dag eller matchende placebo. Størstedelen af patienterne (80%) var i fuld overensstemmelse med CPAP, defineret som CPAP-brug> 4 timer / nat på> 70% nætter. Resten var delvis CPAP-kompatible, defineret som CPAP-brug 30% nætter. CPAP-anvendelse fortsatte gennem hele undersøgelsen. De primære mål for effektivitet var 1) søvnforsinkelse, vurderet ved hjælp af opretholdelse af vågenhedstest (MWT) og 2) ændring i patientens samlede sygdomsstatus, målt ved det kliniske globale indtryk af ændring (CGI-C) i uge 12 eller den endelige besøg. (Se Kliniske spor, Afsnit Narkolepsi ovenfor for en beskrivelse af disse test.)
Patienter behandlet med Provigil viste en statistisk signifikant forbedring af evnen til forblive vågen sammenlignet med placebo-behandlede patienter målt ved MWT (p <0,001) ved slutpunktet [Tabel 1]. Provigil-behandlede patienter viste også en statistisk signifikant forbedring i klinisk tilstand som bedømt efter CGI-C-skalaen (p <0,001) [Tabel 2]. De to doser Provigil udførte lignende.
I den anden undersøgelse, et 4-ugers placebo-kontrolleret multicenter-forsøg, blev 157 patienter randomiseret til enten Provigil 400 mg / dag eller placebo. Dokumentation for regelmæssig CPAP-brug (mindst 4 timer / nat på 70% af nætterne) var påkrævet for alle patienter. Det primære resultatmål var ændringen fra baseline på ESS ved uge 4 eller sidste besøg. Basislinjen ESS-scoringer for Provigil- og placebogrupperne var henholdsvis 14,2 og 14,4. I uge 4 blev ESS reduceret med 4,6 i Provigil-gruppen og med 2,0 i placebogruppen, en forskel, der var statistisk signifikant (p <0,0001).
Nattsøvn målt med polysomnografi blev ikke påvirket af brugen af Provigil.
Shift Work Sleep Disorder (SWSD)
Effektiviteten af Provigil for overdreven søvnighed forbundet med SWSD blev vist i et 12-ugers placebokontrolleret klinisk forsøg. I alt 209 patienter med kronisk SWSD blev randomiseret til at modtage Provigil 200 mg / dag eller placebo. Alle patienter opfyldte den internationale klassifikation af søvnforstyrrelser (ICSD-10) kriterier for kronisk SWSD (som er) i overensstemmelse med American Psychiatric Association DSM-IV kriterier for døgnrytme søvnforstyrrelse: Skiftarbejde Type). Disse kriterier inkluderer 1) enten: a) en primær klage over overdreven søvnighed eller søvnløshed, som midlertidigt er forbundet med en arbejdsperiode (normalt natarbejde), som forekommer i den sædvanlige søvnfase, eller b) polysomnografi, og MSLT viser tab af et normalt søvn-vågent mønster (dvs. forstyrret kronobiologisk rytme); og 2) ingen anden medicinsk eller mental lidelse tegner sig for symptomerne, og 3) symptomerne ikke opfylder kriterierne for enhver anden søvnforstyrrelse, der producerer søvnløshed eller overdreven søvnighed (f.eks. ændring af tidszone [jet lag] syndrom).
Det skal bemærkes, at ikke alle patienter med en klage over søvnighed, der også beskæftiger sig med skiftarbejde, opfylder kriterierne for diagnose af SWSD. I det kliniske forsøg blev kun patienter, der var symptomatiske i mindst 3 måneder, tilmeldt.
Tilmeldte patienter blev også forpligtet til at arbejde mindst 5 natskift om måneden, have overdreven søvnighed ved tidspunkt for deres nattskift (MSLT-score <6 minutter), og har søvnløshed på dagen dokumenteret af et polysomnogram om dagen (PSG).
De primære mål for effektivitet var 1) søvnforsinkelse som vurderet ved Multiple Sleep Latency Test (MSLT) udført under et simuleret natskift i uge 12 eller det sidste besøg og 2) ændringen i patientens samlede sygdomsstatus, målt ved den kliniske globale indtryk af ændring (CGI-C) i uge 12 eller den endelige besøg. Patienter behandlet med Provigil viste en statistisk signifikant forlængelse i tid til søvnudbrudd sammenlignet med placebo-behandlede patienter, som målt ved MSLT om natten [Tabel 1] (p <0,05). Forbedring af CGI-C blev også observeret at være statistisk signifikant (p <0,001). (Se Kliniske spor, Afsnit Narkolepsi ovenfor for en beskrivelse af disse test.)
Døgnssøvn målt med polysomnografi blev ikke påvirket af brugen af Provigil.
HTML udklipsholder
| Sygdom | Måle | Provigil 200 mg * |
Provigil 400 mg * |
Placebo | |||
| * Signifikant anderledes end placebo for alle forsøg (p <0,01 for alle forsøg men SWSD, som var p <0,05) | |||||||
| Baseline | Lave om fra baseline |
Baseline | Lave om fra baseline |
Baseline | Skift fra Baseline |
||
| Narkolepsi I | MWT | 5.8 | 2.3 | 6.6 | 2.3 | 5.8 | -0.7 |
| Narkolepsi II | MWT | 6.1 | 2.2 | 5.9 | 2.0 | 6.0 | -0.7 |
| OSAHS | MWT | 13.1 | 1.6 | 13.6 | 1.5 | 13.8 | -1.1 |
| SWSD | MSLT | 2.1 | 1.7 | - | - | 2.0 | 0.3 |
| Sygdom | Provigil 200 mg * |
Provigil 400 mg * |
Placebo |
| * Betydeligt anderledes end placebo for alle forsøg (p <0,01) | |||
| Narkolepsi I | 64% | 72% | 37% |
| Narkolepsi II | 58% | 60% | 38% |
| OSAHS | 61% | 68% | 37% |
| SWSD | 74% | - | 36% |
top
Indikationer og anvendelse
Provigil er indiceret til at forbedre vågenheden hos voksne patienter med overdreven søvnighed forbundet med narkolepsi, obstruktiv søvnapnø / hypopnea syndrom og søvnforstyrrelse i skiftarbejde.
I OSAHS er Provigil indikeret som et supplement til standardbehandling (er) for den underliggende forhindring. Hvis kontinuerligt positivt luftvejstryk (CPAP) er behandlingen, der vælges for en patient, bør der gøres en maksimal indsats for at behandle med CPAP i et passende tidsrum, inden Provigil påbegyndes. Hvis Provigil bruges sammen med CPAP, er tilskyndelse til og periodisk vurdering af CPAP-overholdelse nødvendig.
I alle tilfælde er omhyggelig opmærksomhed på diagnosen og behandlingen af den eller de underliggende søvnforstyrrelser meget vigtig. Forskrifterne skal være opmærksomme på, at nogle patienter kan have mere end en søvnforstyrrelse, der bidrager til deres overdreven søvnighed.
Effekten af modafinil ved langtidsbrug (mere end 9 uger i kliniske forsøg med narkolepsi og 12 uger i kliniske forsøg med OSAHS og SWSD) er ikke systematisk evalueret i placebokontrolleret forsøg. Lægen, der vælger at ordinere Provigil i en længere periode hos patienter med narkolepsi, OSAHS eller SWSD, skal med jævne mellemrum revurdere den langsigtede brugbarhed for den enkelte patient.
top
Kontraindikationer
Provigil er kontraindiceret til patienter med kendt overfølsomhed over for modafinil, armodafinil eller dets inaktive ingredienser.
top
Advarsler
Alvorligt udslæt, inklusive Stevens-Johnson syndrom
Der er rapporteret om alvorligt udslæt, der kræver indlæggelse og seponering af behandlingen hos voksne og børn i forbindelse med brugen af modafinil.
Modafinil er ikke godkendt til brug til pædiatriske patienter til nogen indikation.
I kliniske forsøg med modafinil var forekomsten af udslæt, der resulterede i seponering, ca. 0,8% (13 pr. 1.585) hos pædiatriske patienter (alder <17 år); disse udslæt inkluderede 1 tilfælde af mulig Stevens-Johnson syndrom (SJS) og 1 tilfælde af tilsyneladende flerorganers overfølsomhedsreaktion. Flere af tilfældene var forbundet med feber og andre abnormiteter (f.eks. Opkast, leukopeni). Den gennemsnitlige tid til udslæt, der resulterede i seponering, var 13 dage. Ingen sådanne tilfælde blev observeret blandt 380 pædiatriske patienter, der modtog placebo. Der er ikke rapporteret om alvorlige hududslæt i voksne kliniske forsøg (0 pr. 4.264) af modafinil.
Sjældne tilfælde af alvorligt eller livstruende udslæt, herunder SJS, toksisk epidermal nekrolyse (TEN) og medikamentudslæt med Eosinophilia og systemiske symptomer (DRESS) er rapporteret hos voksne og børn i verdensmarkedet efter markedsføring erfaring. Rapporteringshastigheden for TEN og SJS i forbindelse med modafinil-brug, som generelt accepteres som en undervurdering på grund af underrapportering, overstiger baggrundshændelsesgraden. Estimater af baggrundsfrekvensen for disse alvorlige hudreaktioner i den generelle population varierer mellem 1 til 2 tilfælde pr. Million år.
Der er ingen faktorer, der vides at forudsige risikoen for forekomst eller sværhedsgraden af udslæt forbundet med modafinil. Næsten alle tilfælde af alvorligt udslæt forbundet med modafinil forekom inden for 1 til 5 uger efter behandlingsstart. Der er dog rapporteret om isolerede tilfælde efter langvarig behandling (f.eks. 3 måneder). Derfor kan behandlingens varighed ikke påberåbes som et middel til at forudsige den potentielle risiko, der er indberettet ved udslætets første udseende.
Selvom godartede udslæt også forekommer med modafinil, er det ikke muligt pålideligt at forudsige, hvilke udslæt der viser sig at være alvorlige. Følgelig bør modafinil normalt seponeres ved det første tegn på udslæt, medmindre udslæt tydeligt ikke er medikamentrelateret. Afbrydelse af behandlingen forhindrer muligvis ikke, at et udslæt bliver livstruende eller permanent deaktiverer eller vanhugger.
Angioødem og anafylaktoide reaktioner
Et alvorligt tilfælde af angioødem og et tilfælde af overfølsomhed (med udslæt, dysfagi og bronkospasme) var observeret blandt 1.595 patienter behandlet med armodafinil, R-enantiomeren af modafinil (som er den racemiske blanding). Ingen sådanne tilfælde blev observeret i kliniske studier med modafinil. Der er dog rapporteret angioødem efter markedsføring med modafinil. Patienter bør rådes til at afbryde behandlingen og straks rapportere til deres læge eventuelle tegn eller symptomer, der antyder angioødem eller anafylaksi (f.eks. hævelse i ansigt, øjne, læber, tunge eller strubehoved; besvær med at synke eller åndedræt; hæshed).
Multiorgan-overfølsomhedsreaktioner
Multiorgan-overfølsomhedsreaktioner, inklusive mindst en dødelighed i postmarketing-oplevelse, har forekom i tæt tidsmæssig tilknytning (median tid til påvisning 13 dage: rækkevidde 4-33) til initieringen af modafinil.
Selvom der har været et begrænset antal rapporter, kan overorganiske hypersensitivitetsreaktioner resultere i hospitalisering eller være livstruende. Der er ingen faktorer, der vides at forudsige risikoen for forekomst eller sværhedsgraden af multi-organ-overfølsomhedsreaktioner forbundet med modafinil. Tegn og symptomer på denne lidelse var forskellige; patienter præsenteres imidlertid typisk, men ikke udelukkende, med feber og udslæt i forbindelse med anden organsysteminddragelse. Andre tilknyttede manifestationer inkluderede myokarditis, hepatitis, leverfunktionsundersøgelser, hæmatologiske abnormiteter (f.eks. eosinophilia, leukopeni, thrombocytopenia), kløe og asteni. Da hypersensitivitet i flere organer er variabel i dens ekspression, kan andre organsystemsymptomer og tegn, der ikke er nævnt her, forekomme.
Hvis der er mistanke om en overorganisk hypersensitivitetsreaktion, skal Provigil seponeres. Selvom der ikke er nogen tilfælde rapporter om indikation af krydsfølsomhed med andre lægemidler, der producerer dette syndrom, erfaringen med medikamenter, der er forbundet med multiorgans overfølsomhed, indikerer, at dette er en mulighed.
Vedvarende søvnighed
Patienter med unormale søvnighedsniveauer, der tager Provigil, skal informeres om, at deres vågenhedsniveau muligvis ikke vender tilbage til det normale. Patienter med overdreven søvnighed, inklusive dem, der tager Provigil, bør ofte revurderes for deres grad af søvnighed og, hvis relevant, rådes til at undgå kørsel eller anden potentielt farlig aktivitet. Forskrifterne skal også være opmærksomme på, at patienter muligvis ikke anerkender søvnighed eller døsighed, før de direkte bliver spurgt om døsighed eller søvnighed under specifikke aktiviteter.
Psykiatriske symptomer
Psykiatriske bivirkninger er rapporteret hos patienter behandlet med modafinil. Bivirkninger efter markedsføring i forbindelse med brugen af modafinil har inkluderet mani, vrangforestillinger, hallucinationer, selvmordstanker og aggression, nogle resulterede i hospitalisering. Mange, men ikke alle, patienter havde en tidligere psykiatrisk historie. En sund mandlig frivillig udviklede ideer om reference, paranoide vrangforestillinger og auditive hallucinationer i forbindelse med flere daglige 600 mg doser af modafinil og søvnmangel. Der var ingen tegn på psykose 36 timer efter seponering af medikament.
I databasen med modafinil-kontrollerede voksne voksne blev psykiatriske symptomer resulteret i seponering af behandlingen (med en frekvens> 0,3%) og rapporteret oftere hos patienter behandlet med modafinil sammenlignet med dem, der blev behandlet med placebo, var angst (1%), nervøsitet (1%), søvnløshed (<1%), forvirring (<1%), agitation (<1%) og depression (<1%). Der skal udvises forsigtighed, når Provigil gives til patienter med en historie med psykose, depression eller mani. Man bør overveje eventuel forekomst eller forværring af psykiatriske symptomer hos patienter, der behandles med Provigil. Hvis psykiatriske symptomer udvikles i forbindelse med Provigil-administration, skal du overveje at afbryde Provigil.
top
Forholdsregler
Diagnose af søvnforstyrrelser
Provigil bør kun bruges til patienter, der har gennemgået en fuldstændig evaluering af deres overdreven søvnighed, og hos hvem a diagnose af enten narkolepsi, OSAHS og / eller SWSD er blevet stillet i overensstemmelse med ICSD- eller DSM-diagnostiske kriterier (se Kliniske spor). En sådan evaluering består normalt af en komplet historie og fysisk undersøgelse, og den kan suppleres med test i laboratorieindstillinger. Nogle patienter kan have mere end en søvnforstyrrelse, der bidrager til deres overdreven søvnighed (f.eks. OSAHS og SWSD sammenfaldende hos den samme patient).
Generel
Selvom modafinil ikke har vist sig at producere funktionsnedsættelse, kan ethvert lægemiddel, der påvirker CNS, ændre dømmekraft, tænkning eller motoriske evner. Patienter skal advares om betjening af en bil eller andet farligt maskiner, indtil de er det med rimelighed sikker på, at Provigil-terapi ikke påvirker deres evne til at deltage i sådan negativt aktiviteter.
CPAP-brug til patienter med OSAHS
I OSAHS er Provigil indikeret som et supplement til standardbehandling (er) for den underliggende forhindring. Hvis kontinuerligt positivt luftvejstryk (CPAP) er behandlingen, der vælges for en patient, bør der gøres en maksimal indsats for at behandle med CPAP i et passende tidsrum, inden Provigil påbegyndes. Hvis Provigil bruges sammen med CPAP, er tilskyndelse til og periodisk vurdering af CPAP-overholdelse nødvendig.
Kardiovaskulære system
Modafinil er ikke evalueret hos patienter med en nylig historie med hjerteinfarkt eller ustabil angina, og sådanne patienter skal behandles med forsigtighed.
I kliniske undersøgelser af Provigil var tegn og symptomer inklusive brystsmerter, hjertebanken, dyspnø og kortvarig iskæmi T-bølgeændringer på EKG blev observeret hos tre individer i forbindelse med mitralventilprolaps eller venstre ventrikulær hypertrofi. Det anbefales, at Provigil tabletter ikke bruges til patienter med en historie med venstre ventrikulær hypertrofi eller i patienter med mitral ventilprolaps, som har oplevet mitralventil prolaps-syndrom, når de tidligere fik CNS stimulanser. Sådanne tegn kan omfatte men er ikke begrænset til iskæmiske EKG-ændringer, brystsmerter eller arytmi. Hvis der opstår et nyt af disse symptomer, skal du overveje hjertevurdering.
Blodtrykovervågning i kortvarige (<3 måneder) kontrollerede forsøg viste ingen klinisk signifikant ændringer i gennemsnitligt systolisk og diastolisk blodtryk hos patienter, der får Provigil sammenlignet med placebo. Imidlertid viste en retrospektiv analyse af brugen af antihypertensiv medicin i disse undersøgelser, at en større andel af patienter på Provigil krævede ny eller forøget brug af antihypertensiv medicin (2,4%) sammenlignet med patienter på placebo (0,7%). Den differentielle anvendelse var lidt større, når kun studier med OSAHS blev inkluderet, med 3,4% af patienterne på Provigil og 1,1% af patienterne på placebo, der kræver sådanne ændringer i brugen af antihypertensiv medicinering. Forøget monitorering af blodtryk kan være passende hos patienter på Provigil.
Patienter, der bruger steroide prævention
Effekten af steroide antikonceptionsmidler kan reduceres, når de bruges sammen med Provigil tabletter og i en måned efter seponering af behandlingen (se Forholdsregler, Lægemiddelinteraktioner). Alternative eller samtidige kontraceptionsmetoder anbefales til patienter, der behandles med Provigil-tabletter, og i en måned efter seponering af Provigil.
Patienter, der bruger Cyclosporine
Blodniveauerne af cyclosporin kan reduceres, når de anvendes sammen med Provigil (se Forholdsregler, Lægemiddelinteraktioner). Overvågning af cirkulerende cyclosporinkoncentrationer og passende dosisjustering for cyclosporin bør overvejes, når disse lægemidler anvendes samtidigt.
Patienter med alvorligt nedsat leverfunktion
Hos patienter med svær leverinsufficiens, med eller uden skrumpeleverancer (se pkt Klinisk farmakologi), Provigil bør administreres i en reduceret dosis (se Dosering og administration).
Patienter med alvorligt nedsat nyrefunktion
Der er utilstrækkelig information til at bestemme doseringens sikkerhed og virkning hos patienter med alvorlig nedsat nyrefunktion. (For farmakokinetik ved nedsat nyrefunktion, se Klinisk farmakologi.)
Ældre patienter
Hos ældre patienter kan eliminering af modafinil og dets metabolitter reduceres som en konsekvens af aldring. Derfor bør der tages hensyn til brugen af lavere doser i denne population. (Se Klinisk farmakologi og Dosering og administration).
Oplysninger til patienter
Læger rådes til at diskutere følgende problemer med patienter, som de ordinerer Provigil til.
Provigil er indiceret til patienter, der har unormale søvnighedsniveauer. Provigil har vist sig at forbedre sig, men ikke fjerne denne unormale tendens til at falde i søvn. Derfor bør patienter ikke ændre deres tidligere opførsel med hensyn til potentielt farlige aktiviteter (f.eks. Kørsel, betjening af maskiner) eller andet aktiviteter, der kræver passende niveauer af vågenhed, indtil og medmindre det er påvist, at behandling med Provigil producerer niveauer af vågenthed, der tillader sådan aktiviteter. Patienter bør informeres om, at Provigil ikke er en erstatning for søvn.
Patienter bør informeres om, at det kan være kritisk, at de fortsætter med at tage deres tidligere ordinerede behandlinger (f.eks. Bør patienter med OSAHS, der får CPAP, fortsætte med at gøre det).
Patienter skal informeres om tilgængeligheden af en patientinformation, og de skal instrueres i at læse indlægssedlen, inden de tages Provigil.
Patienter bør rådes til at kontakte deres læge, hvis de oplever brystsmerter, udslæt, depression, angst eller tegn på psykose eller mani.
Graviditet
Patienter bør rådes til at underrette deres læge, hvis de bliver gravide eller har til hensigt at blive gravide under behandlingen. Patienter skal advares med hensyn til den potentielle øgede risiko for graviditet, når de bruger steroide antikonceptionsmidler (inklusive depot eller implanterbart) antikonceptionsmidler med Provigil og i en måned efter seponering af behandlingen (se Karcinogenese, Mutagenese, Nedsat fertilitet og Graviditet).
Ammende
Patienter bør rådes til at underrette deres læge, hvis de ammer et spædbarn.
Samtidig medicin
Patienter bør rådes til at informere deres læge, hvis de tager eller planlægger at tage noget receptpligtig medicin eller uden recept, på grund af potentialet for interaktioner mellem Provigil og andre stoffer.
Alkohol
Patienter bør informeres om, at brugen af Provigil i kombination med alkohol ikke er blevet undersøgt. Patienter bør informeres om, at det er forsigtigt at undgå alkohol, mens de tager Provigil.
Allergiske reaktioner
Patienter bør rådes til at stoppe med at tage Provigil og at underrette deres læge, hvis de udvikler udslæt, nældefeber, mundskader, blemmer, hudskrælning, problemer med at synke eller åndedræt eller en beslægtet allergik fænomen.
Lægemiddelinteraktioner
CNS aktive stoffer
Methylphenidat
I en enkeltdosisundersøgelse hos raske frivillige, samtidig administration af modafinil (200 mg) sammen med methylphenidat (40 mg) forårsagede ingen signifikante ændringer i farmakokinetikken for nogen af disse narkotika. Absorptionen af Provigil kan imidlertid blive forsinket med cirka en time, når den administreres sammen med methylphenidat.
I en multiple dosis, steady-state-undersøgelse hos raske frivillige, blev modafinil administreret en gang dagligt med 200 mg / dag i 7 dage efterfulgt af 400 mg / dag i 21 dage. Indgivelse af methylphenidat (20 mg / dag) i dag 22-28 modafinilbehandling 8 timer efter den daglige dosis af modafinil forårsagede ingen signifikante ændringer i farmakokinetikken i modafinil.
dextroamphetamin
I en enkeltdosisundersøgelse hos raske frivillige, samtidig administration af modafinil (200 mg) sammen med dextroamphetamin (10 mg) forårsagede ingen signifikante ændringer i farmakokinetikken for nogen af disse narkotika. Absorptionen af Provigil kan imidlertid blive forsinket med cirka en time, når den administreres sammen med dextroamphetamin.
I en multiple dosis, steady-state-undersøgelse hos raske frivillige, blev modafinil administreret en gang dagligt med 200 mg / dag i 7 dage efterfulgt af 400 mg / dag i 21 dage. Administration af dextroamphetamin (20 mg / dag) i dag 22-28 af modafinilbehandling 7 timer efter den daglige dosis af modafinil forårsagede ingen signifikante ændringer i farmakokinetikken i modafinil.
Clomipramin
Samtidig administration af en enkelt dosis clomipramin (50 mg) den første af tre dages behandling med modafinil (200 mg / dag) hos raske frivillige udviste ikke en effekt på farmakokinetikken for et hvilket som helst lægemiddel. En hændelse med øgede niveauer af clomipramin og dets aktive metabolit desmethylclomipramin er imidlertid rapporteret hos en patient med narkolepsi under behandling med modafinil.
triazolam
I lægemiddelinteraktionsundersøgelsen mellem Provigil og ethinyløstradiol (EE2) på de samme dage som for ved plasmaprøveudtagning for farmakokinetik for EE2 blev der indgivet en enkelt dosis triazolam (0,125 mg). Gennemsnitlig Cmax og AUC0-ß for triazolam blev reduceret med henholdsvis 42% og 59%, og dens eliminationshalveringstid blev reduceret ca. en time efter modafinilbehandlingen.
Monoamine Oxidase (MAO) -inhibitorer
Interaktionsundersøgelser med monoaminoxidaseinhibitorer er ikke blevet udført. Derfor skal der udvises forsigtighed, når MAO-hæmmere og modafinil administreres samtidig.
Andre stoffer
Warfarin
Der var ingen signifikante ændringer i de farmakokinetiske profiler af R- og S-warfarin hos raske forsøgspersoner, der fik en enkelt dosis racemisk warfarin (5 mg) efter kronisk indgivelse af modafinil (200 mg / dag i 7 dage efterfulgt af 400 mg / dag i 27 dage) i forhold til profilerne hos indgivne personer placebo. Dog anbefales hyppigere overvågning af protrombintider / INR, hver gang Provigil administreres sammen med warfarin (se Klinisk farmakologi, Farmakokinetik, stof-lægemiddelinteraktioner).
Ethinyl Estradiol
Administration af modafinil til kvindelige frivillige en gang dagligt ved 200 mg / dag i 7 dage efterfulgt af 400 mg / dag i 21 dage resulterede i et gennemsnitligt 11% fald i Cmax og 18% fald i AUC0-24 af ethinyløstradiol (EE2; 0,035 mg; administreres oralt med norgestimate). Der var ingen tilsyneladende ændring i eliminationsgraden for ethinyløstradiol.
Cyclosporin
Et tilfælde af en interaktion mellem modafinil og cyclosporin, et substrat af CYP3A4, er rapporteret hos en 41 år gammel kvinde, der havde gennemgået en organtransplantation. Efter en måneds administration af 200 mg / dag modafinil blev cyclosporinblodniveauerne faldet med 50%. Interaktionen blev postuleret skyldes den øgede metabolisme af cyclosporin, da ingen anden faktor, der forventedes at påvirke doseringen af lægemidlet, havde ændret sig. Dosisjustering af cyclosporine kan være nødvendig.
Potentielle interaktioner med medikamenter, der inhiberer, inducerer eller metaboliseres af cytokrom P-450 isoenzymer og andre leverenzymer
I in vitro-undersøgelser ved anvendelse af primære humane hepatocytkulturer blev modafinil vist let at inducere CYP1A2, CYP2B6 og CYP3A4 på en koncentrationsafhængig måde. Selvom induktionsresultater baseret på in vitro-eksperimenter ikke nødvendigvis er forudsigelige for respons in vivo, er forsigtighed skal udøves, når Provigil administreres sammen med lægemidler, der afhænger af disse tre enzymer for deres clearance. Specifikt kan lavere blodniveauer af sådanne lægemidler resultere (se andre stoffer, cyclosporinea over).
Eksponering af humane hepatocytter for modafinil in vitro frembragte en tilsyneladende koncentrationsrelateret undertrykkelse af ekspression af CYP2C9-aktivitet hvilket antyder, at der er et potentiale for en metabolisk interaktion mellem modafinil og substraterne i dette enzym (f.eks. S-warfarin og phenytoin). I en efterfølgende klinisk undersøgelse med raske frivillige, viste kronisk modafinilbehandling ikke en signifikant effekt på farmakokinetikken for warfarin i en enkelt dosis sammenlignet med placebo (se Forholdsregler, Lægemiddelinteraktioner, Warfarin).
In vitro-undersøgelser ved anvendelse af humane levermikrosomer viste, at modafinil reversibelt inhiberede CYP2C19 ved farmakologisk relevante koncentrationer af modafinil. CYP2C19 hæmmes også reversibelt, med lignende styrke, af en cirkulerende metabolit, modafinil sulfone. Selvom de maksimale plasmakoncentrationer af modafinil sulfon er meget lavere end forælder modafinil, kunne den kombinerede virkning af begge forbindelser producere vedvarende delvis inhibering af enzym. Lægemidler, der i vid udstrækning elimineres via CYP2C19 stofskifte, såsom diazepam, propranolol, phenytoin (også via CYP2C9) eller S-mephenytoin kan have forlænget eliminering efter samtidig administration med Provigil og kan kræve dosisreduktion og overvågning for toksicitet.
Tricykliske antidepressiva
CYP2C19 tilvejebringer også en tilknyttet vej til metabolismen af visse tricykliske antidepressiva (f.eks. Clomipramin og desipramin), der primært metaboliseres af CYP2D6. Hos tricyklisk behandlede patienter, der er mangelfulde i CYP2D6 (dvs. dem, der er ringe metaboliserende stoffer af debrisoquin; 7-10% af den kaukasiske befolkning; lignende eller lavere i andre populationer), kan mængden af metabolisme med CYP2C19 øges betydeligt. Provigil kan forårsage forhøjelse af niveauerne af tricykliske forbindelser i denne undergruppe af patienter. Læger skal være opmærksomme på, at det kan være nødvendigt med en reduktion i dosis af tricykliske midler hos disse patienter.
På grund af den delvise involvering af CYP3A4 i den metaboliske eliminering af modafinil, blev samtidig administration af potente inducerere af CYP3A4 samtidig (f.eks. carbamazepin, phenobarbital, rifampin) eller hæmmere af CYP3A4 (f.eks. ketoconazol, itraconazol) kunne ændre plasmaniveauerne for modafinil.
Karcinogenese, mutagenese, forringelse af fertilitet
carcinogenese
Carcinogenicitetsundersøgelser blev udført, hvor modafinil blev administreret i kosten til mus i 78 uger og til rotter i 104 uger i doser på 6, 30 og 60 mg / kg / dag. Den højeste undersøgte dosis er 1,5 (mus) eller 3 (rotte) gange større end den anbefalede voksne, daglige dosis modafinil (200 mg) på mg / m2-basis. Der var ingen tegn på tumorigenese forbundet med modafinil administration i disse undersøgelser. Da musestudiet imidlertid anvendte en utilstrækkelig høj dosis, som ikke var repræsentativ for en maksimalt tolereret dosis, blev der udført en efterfølgende carcinogenicitetsundersøgelse i Tg. AC transgen mus. Doser evalueret i Tg. AC-assay blev 125, 250 og 500 mg / kg / dag indgivet dermalt. Der var ingen tegn på tumorigenicitet forbundet med modafinil indgivelse; dog kan denne hudmodel muligvis ikke tilstrækkelig vurdere det kræftfremkaldende potentiale af et oralt indgivet lægemiddel.
mutagenese
Modafinil viste intet bevis for mutagent eller clastogent potentiale i en serie in vitro (dvs. bakteriel revers mutationsassay, muselymfom-tk-assay, kromosomal afvigelse assay i humane lymfocytter, celletransformation assay i BALB / 3T3 musembryo-celler) assays i fravær eller tilstedeværelse af metabolisk aktivering eller in vivo (mus knoglemarvsmikronukleus) assays. Modafinil var også negativt i den ikke-planlagte DNA-syntese-analyse i hepatocytter fra rotter.
Nedskrivning af fertilitet
Oral administration af modafinil (doser op til 480 mg / kg / dag) til han- og hunrotter før og gennem parring og fortsættelse hos kvinder gennem svangerskabets dag 7 producerede en stigning i tiden til parring på det højeste dosis; ingen effekter blev observeret på andre fertilitets- eller reproduktionsparametre. Dosis uden virkning på 240 mg / kg / dag var forbundet med en plasma-modafinil-eksponering (AUC), der var omtrent lig med den hos mennesker i den anbefalede dosis på 200 mg.
Graviditet
Graviditet kategori C:
I undersøgelser udført på rotter og kaniner blev der observeret udviklingstoksicitet ved klinisk relevant eksponering.
Modafinil (50, 100 eller 200 mg / kg / dag) administreret oralt til drægtige rotter i hele organogenese-perioden forårsaget, i fravær af maternel toksicitet, en stigning i resorptioner og en øget forekomst af viscerale og skeletvariationer i afkom som højest dosis. Den højere dosis uden virkning for rotter embryofetal udviklingstoksicitet var forbundet med et plasma modafinil eksponering ca. 0,5 gange AUC hos mennesker i den anbefalede daglige dosis (RHD) på 200 mg. I en efterfølgende undersøgelse på op til 480 mg / kg / dag (plasmamodafinil-eksponering ca. 2 gange AUC hos mennesker ved RHD) blev der imidlertid ikke observeret nogen bivirkninger på embryofetaludvikling.
Modafinil administreret oralt til drægtige kaniner i hele organogenesen i doser på 45, 90 og 180 mg / kg / dag øgede forekomsten af føtal strukturelle ændringer og embryofetalt død ved den højeste dosis. Den højeste dosis uden virkning for udviklingstoksicitet var forbundet med en plasma-modafinil AUC, der var omtrent lig med AUC hos mennesker ved RHD.
Oral administration af armodafinil (R-enantiomeren af modafinil; 60, 200 eller 600 mg / kg / dag) til gravide rotter i hele organogenese-perioden resulterede i øgede forekomster af føtale viscerale og skeletvariationer i den mellemliggende dosis eller større og formindskede føtal legemsvægt som højest dosis. Dosis uden virkning for embryofetalt udviklings toksicitet hos rotter var forbundet med en plasma-armodafinil eksponering (AUC) ca. en tiendedel af AUC for armodafinil hos mennesker behandlet med modafinil ved RHD.
Modafinil administration til rotter i hele drægtighed og amning i orale doser på op til 200 mg / kg / dag resulterede i nedsat levedygtighed i afkommet i doser større end 20 mg / kg / dag (plasma modafinil AUC ca. 0,1 gange AUC hos mennesker ved RHD). Der blev ikke observeret nogen effekter på postnatal udviklings- og neurobehalingsparametre hos overlevende afkom.
Der er ingen tilstrækkelige og godt kontrollerede studier på gravide kvinder. Der er rapporteret om to tilfælde af intrauterin væksthæmning og et tilfælde af spontan abort i forbindelse med armodafinil og modafinil. Selvom farmakologien for modafinil og armodafinil ikke er identisk med den for de sympatomimetiske aminer, deler de nogle farmakologiske egenskaber med denne klasse. Visse af disse lægemidler er blevet forbundet med intrauterin væksthæmning og spontane aborter. Hvorvidt de rapporterede tilfælde er narkotikarelaterede vides ikke.
Modafinil bør kun bruges under graviditet, hvis den potentielle fordel retfærdiggør den potentielle risiko for fosteret.
Arbejdskraft og levering
Effekten af modafinil på fødsel og levering hos mennesker er ikke systematisk undersøgt.
Sygeplejerske mødre
Det vides ikke, om modafinil eller dets metabolitter udskilles i modermælk. Da mange lægemidler udskilles i modermælk, skal der udvises forsigtighed, når Provigil-tabletter administreres til en ammende kvinde.
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter under 16 år er ikke fastlagt. Alvorlige hududslæt, inklusive erythema multiforme major (EMM) og Stevens-Johnson syndrom (SJS), har været forbundet med modafinil-brug hos børn. Advarsler, Alvorligt udslæt, inklusive Stevens-Johnson-syndrom).
I et kontrolleret 6-ugers studie blev 165 pædiatriske patienter (i alderen 5-17 år) med narkolepsi behandlet med modafinil (n = 123) eller placebo (n = 42). Der var ingen statistisk signifikante forskelle, der favoriserede modafinil frem for placebo i forlængelse af søvnforsinkelse som målt ved MSLT eller i opfattelsen af søvnighed som bestemt ved den kliniske globale indtrykskliniker-skala (CGI-C).
I de kontrollerede og åbne kliniske undersøgelser behandlede nye bivirkninger i det psykiatriske og nervesystemet behandling inkluderet Tourettes syndrom, søvnløshed, fjendtlighed, øget kataplexi, øget hypnagogisk hallucinationer og selvmord selvmordstanker. Forbigående leukopeni, der opløste uden medicinsk indgriben, blev også observeret. I den kontrollerede kliniske undersøgelse oplevede 3 af 38 piger, i alderen 12 år eller ældre, behandlet med modafinil dysmenorrhea sammenlignet med 0 ud af 10 piger, der fik placebo.
Geriatrisk brug
Sikkerhed og effektivitet hos personer over 65 år er ikke fastlagt. Erfaring hos et begrænset antal patienter, der var over 65 år i kliniske forsøg, viste en forekomst af bivirkninger, der ligner andre aldersgrupper.
top
Bivirkninger
Modafinil er evalueret for sikkerhed hos over 3500 patienter, hvoraf mere end 2000 patienter med overdreven søvnighed forbundet med primære søvnforstyrrelser og vågenhed blev givet mindst en dosis af modafinil. I kliniske forsøg har modafinil vist sig at være generelt godt tolereret, og de fleste bivirkninger var milde til moderate.
De hyppigst observerede bivirkninger (â ¥ ¥ 5%) forbundet med brugen af Provigil hyppigere end placebo-behandlede patienter i den placebokontrollerede kliniske undersøgelser af primære søvnforstyrrelser og vågenthed var hovedpine, kvalme, nervøsitet, rhinitis, diarré, rygsmerter, angst, søvnløshed, svimmelhed og dyspepsi. Profilen med bivirkninger var ens på tværs af disse undersøgelser.
I de placebokontrollerede kliniske forsøg ophørte 74 af de 934 patienter (8%), der modtog Provigil, på grund af en bivirkning sammenlignet med 3% af de patienter, der fik placebo. De hyppigste årsager til seponering, der fandt sted med en højere hastighed for Provigil end placebo patienter var hovedpine (2%), kvalme, angst, svimmelhed, søvnløshed, brystsmerter og nervøsitet (hver <1%). I et canadisk klinisk forsøg var en 35 år gammel fede narkoleptisk mand med en tidligere historie med synkopale episoder oplevede en 9-sekunders episode af asystol efter 27 dages modafinilbehandling (300 mg / dag opdelt doser).
Forekomst i kontrollerede forsøg
Den følgende tabel (tabel 3) viser de bivirkninger, der opstod med en hastighed på 1% eller mere og var hyppigere hos voksne patienter behandlet med Provigil end hos placebo-behandlede patienter i den vigtigste, placebokontrollerede kliniske forsøg.
Foreskriveren skal være opmærksom på, at nedenstående figurer ikke kan bruges til at forudsige hyppigheden af uheldige oplevelser i løbende sædvanlig medicinsk praksis, hvor patientkarakteristika og andre faktorer kan afvige fra dem, der opstår under klinisk behandling undersøgelser. Tilsvarende kan de nævnte frekvenser ikke direkte sammenlignes med tal, der er opnået fra andre kliniske undersøgelser, der involverer forskellige behandlinger, anvendelser eller efterforskere. Gennemgang af disse frekvenser giver imidlertid forskrifterne et grundlag for at estimere det relative bidrag fra lægemiddel- og ikke-medikamentfaktorer til forekomsten af bivirkninger i den undersøgte population.
| Kropssystem | Foretrukket periode | Modafinil (n = 934) |
Placebo (n = 567) |
| * Seks dobbeltblinde, placebokontrollerede kliniske studier på narkolepsi, OSAHS og SWSD. 1 Begivenheder rapporteret af mindst 1% af patienterne behandlet med Provigil, som var hyppigere end i placebogruppen, er inkluderet; forekomsten afrundes til den nærmeste 1%. Terminologien for uønskede oplevelser kodes ved hjælp af en standardmodificeret COSTART-ordbog. Begivenheder, hvor Provigil-forekomsten var mindst 1%, men lig med eller mindre end placebo, er ikke anført i tabellen. Disse begivenheder omfattede følgende: infektion, smerter, utilsigtet skade, mavesmerter, hypotermi, allergisk reaktion, asthenia, feber, virusinfektion, nakkesmerter, migræne, unormal elektrokardiogram, hypotension, tandlidelse, opkast, periodontal abscess, øget appetit, ekkymose, hyperglykæmi, perifert ødem, vægttab, vægt gevinst, myalgi, kramper i benene, leddgigt, kataplexi, tænkende abnormitet, søvnforstyrrelse, øget hoste, bihulebetændelse, dyspnø, bronkitis, udslæt, konjunktivitis, øre smerter, dysmenoré4, urinvejsinfektion. 2 Forhøjede leverenzymer. 3 Oro-facial dyskinesier. 4 Forekomst justeret for køn. | |||
| Krop som helhed | Hovedpine | 34% | 23% |
| Rygsmerte | 6% | 5% | |
| Influenzasyndrom | 4% | 3% | |
| Brystsmerter | 3% | 1% | |
| kuldegysninger | 1% | 0% | |
| Halsstivhed | 1% | 0% | |
| Hjerte-kar- | Forhøjet blodtryk | 3% | 1% |
| Takykardi | 2% | 1% | |
| hjertebanken | 2% | 1% | |
| vasodilatation | 2% | 0% | |
| Digestive | Kvalme | 11% | 3% |
| Diarré | 6% | 5% | |
| Dyspepsi | 5% | 4% | |
| Tør mund | 4% | 2% | |
| Anoreksi | 4% | 1% | |
| Forstoppelse | 2% | 1% | |
| Unormal leverfunktion2 | 2% | 1% | |
| flatulens | 1% | 0% | |
| Sår i munden | 1% | 0% | |
| Tørst | 1% | 0% | |
| Blod- / lymfatisk | eosinofili | 1% | 0% |
| Metabolisk / Ernæringsmæssige | Ødem | 1% | 0% |
| Nervøs | Nervøsitet | 7% | 3% |
| Søvnløshed | 5% | 1% | |
| Angst | 5% | 1% | |
| svimmelhed | 5% | 4% | |
| Depression | 2% | 1% | |
| Parestesi | 2% | 0% | |
| søvnighed | 2% | 1% | |
| Hypertoni | 1% | 0% | |
| Dyskinesi3 | 1% | 0% | |
| hyperkinesi | 1% | 0% | |
| Agitation | 1% | 0% | |
| Forvirring | 1% | 0% | |
| Rysten | 1% | 0% | |
| Følelsesmæssig labilitet | 1% | 0% | |
| svimmelhed | 1% | 0% | |
| Respiratory | Rhinitis | 7% | 6% |
| Pharyngitis | 4% | 2% | |
| Lungesygdom | 2% | 1% | |
| næseblod | 1% | 0% | |
| Astma | 1% | 0% | |
| Hud / Vedhæng | Svedende | 1% | 0% |
| Herpes simplex | 1% | 0% | |
| Specielle sanser | amblyopi | 1% | 0% |
| Unormal vision | 1% | 0% | |
| Smag perversion | 1% | 0% | |
| Øjenesmerter | 1% | 0% | |
| urogenital | Urin abnormitet | 1% | 0% |
| hæmaturi | 1% | 0% | |
| pyuri | 1% | 0% |
Dosisafhængighed af bivirkninger
I de voksne placebokontrollerede kliniske forsøg, der sammenlignede doser på 200, 300 og 400 mg / dag af Provigil og placebo, de eneste bivirkninger, der tydeligt var dosisrelateret, var hovedpine og angst.
Ændring af vital tegn
Mens der ikke var nogen konstant ændring i middelværdierne for hjerterytme eller systolisk og diastolisk blodtryk, var kravet til antihypertensiv medicin var lidt større hos patienter på Provigil sammenlignet med placebo (se Forholdsregler).
Vægtændringer
Der var ingen klinisk signifikante forskelle i ændring af kropsvægt hos patienter behandlet med Provigil sammenlignet med placebo-behandlede patienter i de placebokontrollerede kliniske forsøg.
Laboratorieændringer
Klinisk kemi, hæmatologi og urinalyseparametre blev overvåget i fase 1, 2 og 3 undersøgelser. I disse undersøgelser viste det sig, at gennemsnitlige plasmaniveauer af gamma glutamyltransferase (GGT) og alkalisk fosfatase (AP) var højere efter administration af Provigil, men ikke placebo. Få forsøgspersoner havde imidlertid GGT- eller AP-forhøjelser uden for det normale interval. Skift til højere, men ikke klinisk signifikant unormale, GGT- og AP-værdier syntes at stige med tiden i befolkningen behandlet med Provigil i de kliniske fase 3-forsøg. Ingen forskelle var synlige i alaninaminotransferase, aspartataminotransferase, totalprotein, albumin eller total bilirubin.
EKG-ændringer
Der blev ikke fundet noget behandlingsmønster af EKG-abnormiteter i placebokontrollerede kliniske forsøg efter administration af Provigil.
Rapporter efter postmarketing
Følgende bivirkninger er blevet identificeret under brug af Provigil efter godkendelse. Da disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng med lægemiddeleksponering. Beslutninger om at inkludere disse reaktioner i mærkning er typisk baseret på en eller flere af følgende faktorer: (1) reaktionens alvor, (2) rapporteringshyppighed eller (3) styrke årsagssammenhæng til Provigil.
Hæmatologisk: agranulocytose
top
Narkotikamisbrug og afhængighed
Kontrolleret stofklasse
Modafinil (Provigil) er opført i skema IV i loven om kontrollerede stoffer.
Misbrug af potentiale og afhængighed
Ud over dets vågne-fremmende virkning og øgede lokomotoriske aktivitet hos dyr producerer Provigil psykoaktive og euforiske effekter, ændringer i humør, opfattelse, tænkning og følelser, der er typiske for andre CNS-stimulanter. I in vitro-bindingsundersøgelser binder modafinil sig til dopamin genoptagelsesstedet og forårsager en stigning i ekstracellulær dopamin, men ingen stigning i dopaminfrigivelse. Modafinil forstærker, som det fremgår af dets selvadministration i aber, der tidligere er trænet til selvadministrering af kokain. I nogle studier blev modafinil også delvist diskrimineret som stimulerende. Læger skal følge patienter nøje, især patienter med en historie med lægemiddel- og / eller stimulant (f.eks. Methylphenidat, amfetamin eller kokain). Patienter skal observeres for tegn på misbrug eller misbrug (f.eks. Forøgelse af doser eller stof-søgende adfærd).
Misfærdspotentialet for modafinil (200, 400 og 800 mg) blev vurderet i forhold til methylphenidat (45 og 90 mg) i en indpatientundersøgelse hos individer, der har oplevet misbrugsmedicin. Resultater fra denne kliniske undersøgelse viste, at modafinil producerede psykoaktive og euforiske effekter og følelser, der var i overensstemmelse med andre planlagte CNS-stimulanter (methylphenidat).
Tilbagetrækning
Virkningerne af modafinil tilbagetrækning blev overvåget efter 9 ugers modafinil anvendelse i et amerikansk fase 3 kontrolleret klinisk forsøg. Der blev ikke observeret nogen specifikke symptomer på abstinens i løbet af 14 dages observation, selvom søvnighed vendte tilbage hos narkoleptiske patienter.
top
overdosering
Menneskelig oplevelse
I kliniske forsøg var i alt 151 protokolspecificerede doser i området fra 1000 til 1600 mg / dag (5 til 8 gange den anbefalede daglige dosis på 200 mg) er blevet administreret til 32 individer, herunder 13 individer, der modtog doser på 1000 eller 1200 mg / dag i 7 til 21 på hinanden følgende dage. Derudover forekom flere forsætlige akutte overdoser; de to største er 4500 mg og 4000 mg taget af to forsøgspersoner, der deltager i undersøgelser med fremmed depression. Ingen af disse forsøgspersoner oplevede nogen uventede eller livstruende virkninger. Bivirkninger, der blev rapporteret ved disse doser, omfattede excitation eller agitation, søvnløshed og let eller moderat forhøjelse af hæmodynamiske parametre. Andre observerede højdosiseffekter i kliniske studier har inkluderet angst, irritabilitet, aggressivitet, forvirring, nervøsitet, rysten, hjertebanken, søvnforstyrrelser, kvalme, diarré og nedsat protrombin tid.
Fra erfaring efter markedsføring har der ikke været rapporteret om dødelige overdoser, der involverer modafinil alene (doser op til 12 gram). Overdoseringer, der involverer flere lægemidler, inklusive modafinil, har resulteret i dødelige resultater. Symptomer, der ofte ledsager overdosis modafinil, alene eller i kombination med andre lægemidler, inkluderer: søvnløshed; symptomer på centralnervesystemet såsom rastløshed, desorientering, forvirring, ophidselse og hallucination; fordøjelsesforandringer såsom kvalme og diarré; og kardiovaskulære ændringer såsom takykardi, bradykardi, hypertension og brystsmerter.
Der er rapporteret tilfælde af utilsigtet indtagelse / overdosering hos børn helt op til 11 måneders alder. Den højest rapporterede utilsigtede indtagelse på basis af mg / kg forekom hos en tre år gammel dreng, der indtog 800-1000 mg (50-63 mg / kg) modafinil. Barnet forblev stabilt. Symptomerne forbundet med overdosering hos børn svarede til dem, der blev observeret hos voksne.
Overdoseadministration
Der er ikke identificeret noget specifikt modgift mod de toksiske virkninger af overdosis modafinil indtil videre. Sådanne overdoser bør håndteres med primært understøttende pleje, herunder kardiovaskulær monitorering. Hvis der ikke er kontraindikationer, skal induceret emese eller gastrisk skylning overvejes. Der er ingen data, der antyder nytten af dialyse eller urinsurning eller alkalinisering til forbedring af lægemiddeleliminering. Lægen bør overveje at kontakte et giftkontrolcenter for behandling af en overdosis.
top
Dosering og administration
Den anbefalede dosis Provigil er 200 mg givet en gang dagligt.
For patienter med narkolepsi og OSAHS bør Provigil tages som en enkelt dosis om morgenen.
For patienter med SWSD skal Provigil tages cirka 1 time før deres arbejdsskifte begynder.
Doser op til 400 mg / dag, givet som en enkelt dosis, er blevet tolereret godt, men der er intet konsistent bevis for, at denne dosis giver yderligere fordele ud over dosis på 200 mg-dosis (se Klinisk farmakologi og Kliniske spor).
Generelle overvejelser
Dosisjustering bør overvejes for samtidig medicin, der er substrater for CYP3A4, såsom triazolam og cyclosporin (se Forholdsregler, Lægemiddelinteraktioner).
Lægemidler, der i vid udstrækning elimineres via CYP2C19 stofskifte, såsom diazepam, propranolol, phenytoin (også via CYP2C9) eller S-mephenytoin kan have forlænget eliminering efter samtidig administration med Provigil og kan kræve dosisreduktion og overvågning for toksicitet.
Hos patienter med alvorlig nedsat leverfunktion bør dosis af Provigil reduceres til halvdelen af den anbefalede til patienter med normal leverfunktion (se CKlinisk farmakologi og Forholdsregler).
Der er utilstrækkelig information til at bestemme doseringens sikkerhed og virkning hos patienter med svær nyreinsufficiens (se Klinisk farmakologi og Forholdsregler).
Hos ældre patienter kan eliminering af Provigil og dets metabolitter reduceres som en konsekvens af aldring. Derfor bør der tages hensyn til brugen af lavere doser i denne population (se Klinisk farmakologi og Forholdsregler).
top
Hvordan leveres
Provigil® (modafinil) tabletter
100 mg: Hver kapselformet, hvid, ikke-overtrukket tablet er præget med "Provigil" på den ene side og "100 MG" på den anden.
NDC 63459-101-01 - Flasker på 100
200 mg: Hver kapselformet, hvid, scoret, ikke-overtrukket tablet er præget med "Provigil" på den ene side og "200 MG" på den anden.
NDC 63459-201-01 - Flasker på 100
Opbevares ved 20 ° - 25 ° C (68 ° - 77 ° F).
Fremstillet til:
Cephalon, Inc.
Frazer, PA 19355
U.S. patent nr. RE37,516 / 4.927.855
© Cephalon, Inc., 2008. Alle rettigheder forbeholdes
PROV-011
Sidst opdateret: 03/08
Provigil (modafinil) patientinformationsark (på almindeligt engelsk)
Detaljeret info om Tegn, symptomer, årsager, behandling af søvnproblemer
Oplysningerne i denne monografi er ikke beregnet til at dække alle mulige anvendelser, instruktioner, forholdsregler, medikamentinteraktion eller ugunstige virkninger. Denne information er generaliseret og er ikke beregnet til specifik medicinsk rådgivning. Hvis du har spørgsmål til de lægemidler, du tager eller ønsker flere oplysninger, skal du kontakte din læge, apotek eller sygeplejerske.
tilbage til:
~ alle artikler om soveforstyrrelser



