Byetta til behandling af diabetes
Brand name: Byetta
Generisk navn: Exenatide
Doseringsform: Injektion
Indhold:
Beskrivelse
Klinisk farmakologi
Kliniske studier
Indikationer og anvendelse
Kontraindikationer
Forholdsregler
Bivirkninger
overdosering
Dosering og administration
Opbevaring
Hvordan leveres
Byetta (Exenatide) Patientinformation (på almindeligt engelsk)
Beskrivelse
Byetta® (exenatid) er et syntetisk peptid, der har incretin-mimetiske handlinger, og som oprindeligt blev identificeret i firben Heloderma fertum. Byetta forbedrer glukoseafhængig insulinudskillelse af pankreatisk beta-celle, undertrykker uhensigtsmæssigt forhøjet glukagon-sekretion og bremser gastrisk tømning. Exenatid adskiller sig i kemisk struktur og farmakologisk virkning fra insulin, sulfonylurinstoffer (inklusive D-phenylalaninderivater og meglitinider), biguanider, thiazolidindioner og alfa-glucosidase inhibitorer.
Exenatid er et 39'amino-syre-peptidamid. Exenatid har den empiriske formel C184H282N50O60S og molekylvægt på 4186,6 Dalton. Aminosyresekvensen for exenatid er vist nedenfor.
H - His - Gly - Glu - Gly - Thr - Phe - Thr - Ser - Asp - Leu - Ser - Lys - Gln - Met - Glu - Glu - Glu - Ala - Val - Arg - Leu - Phe - Ile - Glu - Trp - Leu - Lys - Asn - Gly - Gly - Pro - Ser - Ser - Gly - Ala - Pro - Pro - Pro - Ser - NH2
Byetta leveres til subkutan (SC) injektion som en steril, konserveret isotonisk opløsning i en glaspatron, der er samlet i en peninjektor (pen). Hver milliliter (ml) indeholder 250 mikrogram (mcg) syntetisk exenatid, 2,2 mg metacresol som et antimikrobielt konserveringsmiddel, mannitol som et tonicitetsjusterende middel, og iseddike og natriumacetat-trihydrat i vand til injektion som en bufferopløsning ved pH 4,5. Der er to forfyldte penne til rådighed til at levere enhedsdoser på 5 mcg eller 10 mcg. Hver forudfyldte pen leverer 60 doser for at give 30 dage med to gange dagligt indgivelse (BID).
top
Klinisk farmakologi
Handlingsmekanisme
Incretiner, såsom glukagonlignende peptid-1 (GLP-1), forbedrer glukoseafhængig insulinudskillelse og udviser andre antihyperglykæmiske handlinger efter deres frigivelse i cirkulationen fra tarmen. Exenatid er et incretin-mimetisk middel, der efterligner forøgelsen af glukoseafhængig insulinudskillelse og adskillige andre antihyperglykæmiske virkninger af incretiner.
Amensyresekvensen for exenatid overlapper delvist den for humant GLP-1. Exenatid har vist sig at binde og aktivere den kendte humane GLP-1 receptor in vitro. Dette fører til en stigning i både glukoseafhængig syntese af insulin og in vivo-sekretion af insulin fra pankreatiske beta-celler ved hjælp af mekanismer, der involverer cyklisk AMP og / eller anden intracellulær signalering pathways. Exenatid fremmer insulinfrigivelse fra beta-celler i nærvær af forhøjede glukosekoncentrationer. Når administreret in vivo, efterligner exenatid visse antihyperglykæmiske virkninger af GLP-1.
Byetta forbedrer den glykæmiske kontrol ved at reducere faste og postprandiale glukosekoncentrationer hos patienter med type 2-diabetes gennem de nedenfor beskrevne handlinger.
Glukoseafhængig insulinsekretion: Byetta har akutte effekter på pancreasbetacellens reaktion over for glukose og fører kun til frigivelse af insulin i nærvær af forhøjede glukosekoncentrationer. Denne insulinsekretion aftager, når blodglukosekoncentrationerne falder og nærmer sig euglycæmi.
Første fase insulinrespons: Hos raske individer forekommer robust insulinsekretion i løbet af de første 10 minutter efter intravenøs (IV) glukoseadministration. Denne sekretion, kendt som "første-fase insulinrespons", er karakteristisk fraværende hos patienter med type 2-diabetes. Tabet af den første fase insulinrespons er en tidlig beta-celledefekt i type 2-diabetes. Indgivelse af Byetta ved terapeutiske plasmakoncentrationer gendannede insulinfasen i første fase på en IV bolus af glukose hos patienter med type 2-diabetes (figur 1). Både første-fase insulinsekretion og anden fase insulinsekret blev øget signifikant hos patienter med type 2-diabetes behandlet med Byetta sammenlignet med saltvand (p
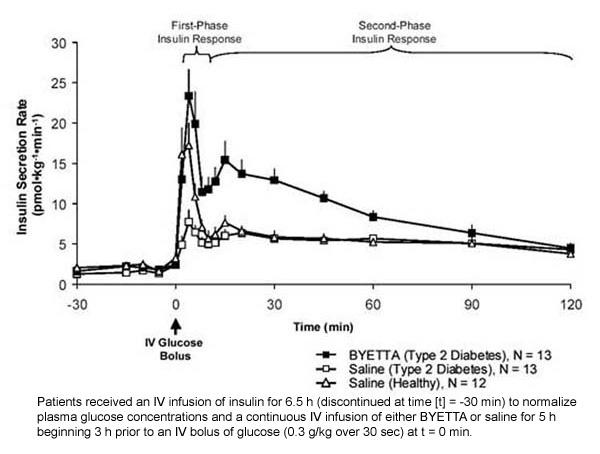
Figur 1: Gennemsnitlig (+ SEM) insulinsekretionshastighed under infusion af Byetta eller saltvand hos patienter med type 2-diabetes og under infusion af saltvand i sunde forsøgspersoner
Glucagon-sekretion: Hos patienter med type 2-diabetes modererer Byetta glukagon-sekretion og sænker koncentrationen af glukagon i serum i perioder med hyperglykæmi. Lavere glukagonkoncentrationer fører til nedsat lever glukoseproduktion og reduceret insulinbehov. Byetta forringer imidlertid ikke det normale glukagonrespons på hypoglykæmi.
Gastrisk tømning: Byetta bremser gastrisk tømning og reducerer derved den hastighed, hvormed måltidsafledt glukose vises i kredsløbet.
Fødevarer: Hos både dyr og mennesker har administration af exenatid vist sig at reducere fødeindtagelsen.
Farmakokinetik
absorption
Efter SC-administration til patienter med type 2-diabetes når exenatid medianens maksimale plasmakoncentration på 2,1 timer. Gennemsnitlig maksimal exenatidkoncentration (CmaxDet samlede middelareal under kurven (AUC0-inf) var 1036 pg-h / ml efter SC-administration af en 10 mcg dosis Byetta. Eksenatideksponering (AUC) steg proportionalt over det terapeutiske dosisområde fra 5 til 10 mg. Cmax-værdierne steg mindre end proportionalt over det samme interval. Lignende eksponering opnås med SC-administration af Byetta i maven, låret eller armen.
Fordeling
Det gennemsnitlige tilsyneladende distributionsvolumen af exenatid efter SC-administration af en enkelt dosis Byetta er 28,3 L.
Metabolisme og eliminering
Ikke-kliniske studier har vist, at exenatid overvejende elimineres ved glomerulær filtrering med efterfølgende proteolytisk nedbrydning. Den gennemsnitlige tilsyneladende clearance af exenatid hos mennesker er 9,1 L / h, og den gennemsnitlige terminale halveringstid er 2,4 timer. Disse farmakokinetiske egenskaber ved exenatid er uafhængige af dosis. I de fleste individer kan exenatidkoncentrationer måles i ca. 10 timer efter dosis.
Særlige befolkninger
Nedsat nyrefunktion
Hos patienter med let til moderat nedsat nyrefunktion (kreatininclearance 30 til 80 ml / min) blev exenatid-clearance kun mildt reduceret; derfor kræves ingen dosisjustering af Byetta hos patienter med let til moderat nedsat nyrefunktion. Hos patienter med slutfase nyresygdom, der får dialyse, reduceres gennemsnitlig exenatid clearance til 0,9 L / h sammenlignet med 9,1 L / h hos raske individer (se FORHOLDSREGLER, Generelt).
Nedsat leverfunktion
Der er ikke udført nogen farmakokinetisk undersøgelse hos patienter med en diagnose af akut eller kronisk leverinsufficiens. Da exenatid primært tømmes af nyrerne, forventes leverdysfunktion ikke at påvirke blodkoncentrationen af exenatid (se Farmakokinetik, Stofskifte og eliminering).
Geriatrisk
Befolkningens farmakokinetiske analyse af patienter (spænder fra 22 til 73 år) antyder, at alder ikke påvirker de farmakokinetiske egenskaber ved exenatid.
Pædiatrisk
Exenatide er ikke undersøgt hos pædiatriske patienter.
Køn
Befolkningens farmakokinetiske analyse af mandlige og kvindelige patienter antyder, at køn ikke har indflydelse på fordelingen og eliminationen af exenatid.
Race
Befolkningens farmakokinetiske analyse af patienter, herunder kaukasiske, latinamerikanske og sorte, antyder, at race ikke har nogen signifikant indflydelse på exenatids farmakokinetik.
Fedme
Befolkningens farmakokinetiske analyse af overvægtige (BMI - 30 kg / m2) og ikke-overvægtige patienter antyder, at fedme ikke har nogen signifikant effekt på exenatids farmakokinetik.
Lægemiddelinteraktioner
Digoxin
Samtidig administration af gentagne doser Byetta (10 mcg BID) reducerede Cmax oralt digoxin (0,25 mg QD) med 17% og forsinkede Tmax med ca. 2,5 timer; den samlede farmakokinetiske eksponering ved stabil tilstand (AUC) blev dog ikke ændret.
Lovastatin
Lovastatin AUC og Cmax blev nedsat henholdsvis 40% og 28%, og Tmax blev forsinket ca. 4 timer, da Byetta (10 mcg BID) blev administreret samtidig med en enkelt dosis lovastatin (40 mg) sammenlignet med lovastatin indgivet alene. I de 30-ugers kontrollerede kliniske forsøg med Byetta, anvendelsen af Byetta til patienter, der allerede fik HMG CoA-reduktaseinhibitorer var ikke forbundet med konsistente ændringer i lipidprofiler sammenlignet med baseline.
Lisinopril
Hos patienter med mild til moderat hypertension, der var stabiliseret på lisinopril (5 til 20 mg / dag), ændrede Byetta (10 mcg BID) ikke steady-state Cmax eller AUC for lisinopril. Lisinopril stabil tilstand Tmax blev forsinket med 2 timer. Der var ingen ændringer i det gennemsnitlige systoliske og diastoliske blodtryk i 24 timer.
Acetaminophen
Når 1000 mg acetaminophen elixir blev givet med 10 mg Byetta (0 timer) og 1 time, 2 timer og 4 timer efter Byetta-injektion, blev AUC'er for acetaminophen reduceret med henholdsvis 21%, 23%, 24% og 14%; Cmax blev reduceret med henholdsvis 37%, 56%, 54% og 41%; Tmax blev øget fra 0,6 timer i kontrolperioden til henholdsvis 0,9 timer, 4,2 timer, 3,3 timer og 1,6 timer. Acetaminophen AUC, Cmax og Tmax blev ikke signifikant ændret, når acetaminophen blev givet 1 time før Byetta-injektion.
Warfarin
Samtidig administration af gentagne doser af Byetta (5 mcg BID på dag 1-2 og 10 mcg BID på dag 3-9) hos raske frivillige, forsinket warfarin (25 mg) Tmax med ca. 2 timer. Der blev ikke observeret klinisk relevante effekter på Cmax eller AUC for S- og R-enantiomerer af warfarin. Byetta ændrede ikke de farmakodynamiske egenskaber (som vurderet ved INR-respons) af warfarin.
farmakodynamik
Postprandial glukose
Hos patienter med type 2-diabetes reducerer Byetta de postprandiale plasmaglucosekoncentrationer (figur 2).
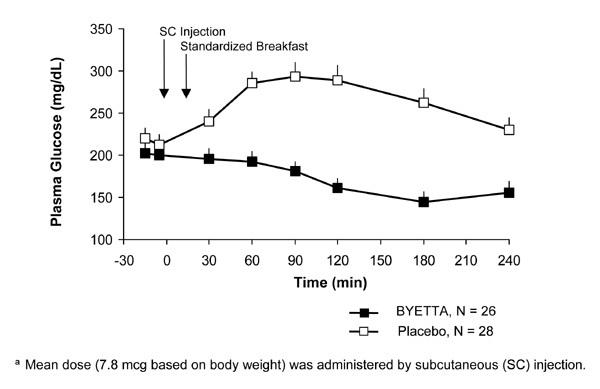
Figur 2: Middel (+ SEM) postprandial plasma-glukosekoncentrationer på Byetta dag 1-en Behandling hos patienter med type 2-diabetes behandlet med Metformin, en sulfonylurinstof eller begge dele (N = 54)
Fastende glukose
I en enkeltdosis crossover-undersøgelse hos patienter med type 2-diabetes og fastende hyperglykæmi fulgte en øjeblikkelig insulinfrigivelse injektion af Byetta. Plasmaglukosekoncentrationer blev signifikant reduceret med Byetta sammenlignet med placebo (figur 3).

Figur 3: Gennemsnitlig (+ SEM) seruminsulin- og plasmaglucosekoncentration efter en engangsinjektion af Byetta-en eller placebo hos faste patienter med type 2-diabetes (N = 12)
top
Kliniske studier
Brug sammen med metformin og / eller en sulfonylurinstof
Tre 30 ugers, dobbeltblinde, placebokontrollerede forsøg blev udført for at evaluere sikkerheden og effektiviteten af Byetta hos patienter med type 2-diabetes, hvis glykæmisk kontrol var utilstrækkelig med metformin alene, et sulfonylurinstof alene eller metformin i kombination med en sulfonylurinstof.
I alt 1446 patienter blev randomiseret i disse tre forsøg: 991 (68,5%) var kaukasiske, 224 (15,5%) var latinamerikanske og 174 (12,0%) var sorte. Gennemsnitlige HbA1c-værdier ved baseline for forsøgene varierede fra 8,2% til 8,7%. Efter en 4-ugers placebo-indleveringsperiode blev patienter tilfældigt tildelt at modtage Byetta 5 mcg BID, Byetta 10 mcg BID, eller placebo-BID før morgen- og aftenmåltider, ud over deres eksisterende orale antidiabetika agent. Alle patienter tildelt Byetta begyndte en behandlingsinitieringsperiode med 5 mcg BID i 4 uger. Efter 4 uger fortsatte disse patienter enten med Byetta 5 mcg BID eller fik deres dosis øget til 10 mcg BID. Patienter, der blev tildelt placebo, fik placebo-bud gennem hele undersøgelsen.
Det primære endepunkt i hver undersøgelse var gennemsnitlig ændring fra basislinien HbA1c efter 30 uger. 30 uger undersøgelsesresultater er sammenfattet i tabel 1.
Tabel 1: Resultater af 30 ugers placebokontrollerede forsøg med Byetta hos patienter med utilstrækkelig glukosekontrol til trods for anvendelse af Metformin, en sulfonylurinstof eller begge dele
| Placebo BUD |
Byetta 5 mcg BID |
Byetta 10 mcg* BUD |
|
|---|---|---|---|
| |||
| I kombination med Metformin | |||
| Befolkning til hensigt at behandle (N) | 113 | 110 | 113 |
| HbA1c (%), Betyde | |||
| Baseline | 8.2 | 8.3 | 8.2 |
| Skift i uge 30 | +0.1 | −0.4†| −0.8c |
| Proportion opnåelse af HbA1c≤7% § | 13.0% | 31.6%†| 46.4%†|
| Kropsvægt (kg), gennemsnit | |||
| Baseline | 99.9 | 100.0 | 100.9 |
| Skift i uge 30 | −0.3 | −1.6†| −2.8c |
| I kombination med en sulfonylurinstof | |||
| Befolkning til hensigt at behandle (N) | 123 | 125 | 129 |
| HbA1c (%), Betyde | |||
| Baseline | 8.7 | 8.5 | 8.6 |
| Skift i uge 30 | +0.1 | −0.5†| −0.9c |
| Proportion opnåelse af HbA1c≤7% § | 8.8% | 32.6%†| 41.3%c |
| Kropsvægt (kg), gennemsnit | |||
| Baseline | 99.1 | 94.9 | 95.2 |
| Skift i uge 30 | −0.6 | −0.9 | −1.6†|
| I kombination med Metformin og en sulfonylurinstof | |||
| Befolkning til hensigt at behandle (N) | 247 | 245 | 241 |
| HbA1c (%), Betyde | |||
| Baseline | 8.5 | 8.5 | 8.5 |
| Skift i uge 30 | +0.2 | −0.6c | −0.8c |
| Proportion opnåelse af HbA1c≤7% § | 9.2% | 27.4%c | 33.5%c |
| Kropsvægt (kg), gennemsnit | |||
| Baseline | 99.1 | 96.9 | 98.4 |
| Skift i uge 30 | −0.9 | −1.6†| −1.6†|
HbA1c
Tilsætningen af Byetta til et regime med metformin, en sulfonylurinstof eller begge dele resulterede i statistisk signifikante reduktioner fra basislinien HbA1c i uge 30 sammenlignet med patienter, der fik placebo føjet til disse midler i de tre kontrollerede forsøg (tabel 1). Derudover blev der observeret en statistisk signifikant dosiseffekt mellem 5-mcg og 10-mcg Byetta-grupper for ændringen fra basislinien HbA1c i uge 30 i de tre undersøgelser.
Fastende og postprandial glukose
Langvarig brug af Byetta i kombination med metformin, en sulfonylurinstof eller begge dele reducerede både faste og postprandiale plasmaglukosekoncentrationer på en statistisk signifikant, dosisafhængig måde gennem ugen 30. En statistisk signifikant reduktion fra baseline i både gennemsnitlig fastende og postprandial glukosekoncentration blev observeret i uge 30 i begge Byetta-grupper sammenlignet med placebo i data kombineret fra de tre kontrollerede forsøg. Ændringen i fastende glukosekoncentration i uge 30 sammenlignet med baseline var â'8 mg / dL for Byetta 5 mcg BID og â''10 mg / dL for Byetta 10 mcg BID sammenlignet med +12 mg / dL for placebo. Ændringen i 2-timers postprandial glukosekoncentration efter administration af Byetta i uge 30 sammenlignet med baseline var âˆ63 mg / dL for 5 mcg BID og âˆ'71 mg / dL for 10 mcg BID sammenlignet med +11 mg / dL for placebo.
Andel af patienter, der opnår HbA1c≤7%
Byetta i kombination med metformin, et sulfonylurinstof eller begge dele resulterede i en større, statistisk signifikant andel af patienter, der opnår en HbA1câ ‰ ¤7% i uge 30 sammenlignet med patienter, der fik placebo i kombination med disse agenter (tabel 1).
Kropsvægt
I de tre kontrollerede forsøg var et fald fra baseline legemsvægt i uge 30 forbundet med Byetta 10 mcg BID sammenlignet med placebo BID hos patienter med type 2 diabetes (tabel 1).
Et års kliniske resultater
Kohorten af 163 patienter fra de 30 ugers placebokontrollerede forsøg, der afsluttede i alt 52 ugers behandling med Byetta 10 mcg BID, havde HbA1c-ændringer fra baseline på â'1.0% og â''1.1% efter henholdsvis 30 og 52 uger af behandlingen med ledsagende ændringer fra basislinien i fastende plasmaglukose på â''14,0 mg / dL og â''25,3 mg / dL og ændringer i kropsvægt på ˆ'2,6 kg og âˆ'3,6 kg. Denne kohort havde baselineværdier svarende til værdierne i hele populationen med kontrolleret forsøg.
Brug sammen med en thiazolidinedion
I et randomiseret, dobbeltblindt, placebokontrolleret forsøg med 16 ugers varighed blev Byetta (n = 121) eller placebo (n = 112) tilføjet til eksisterende thiazolidinedion (pioglitazon eller rosiglitazon) behandling, med eller uden metformin, hos patienter med type 2-diabetes med utilstrækkelig glykæmisk kontrol. Tilfældighed til Byetta eller placebo blev lagdelt baseret på, om patienterne modtog metformin. Patienter, der blev tildelt placebo, fik placebo-bud gennem hele undersøgelsen. Byetta eller placebo blev injiceret subkutant før morgen- og aftenmåltiderne. 79 procent af patienterne tog en thiazolidinedion og metformin, og 21% tog alene en thiazolidinedione. Størstedelen af patienterne (84%) var kaukasiske, 8% var latinamerikanske og 3% var sorte. Den gennemsnitlige basislinje HbA1c-værdier var ens for Byetta og placebo (7,9%). Byetta-behandling blev påbegyndt i en dosis på 5 mcg BID i 4 uger og blev derefter øget til 10 mcg BID i 12 uger mere.
Seksten ugers undersøgelsesresultater er sammenfattet i tabel 2. Sammenlignet med placebo resulterede Byetta i statistisk signifikante reduktioner i HbA1c fra baseline i uge 16. Behandlingseffekter for HbA1c var ens i de to undergrupper defineret af underliggende behandlingsstratum (thiazolidinedioner alene mod thiazolidinedioner plus metformin). Ændringen i fastende serumglukosekoncentration fra basislinje til uge 16 var statistisk signifikant sammenlignet med placebo (â21 mg / dl for Byetta 10 mcg BID sammenlignet med +4 mg / dL for placebo).
Tabel 2: Resultater af en 16-ugers placebokontrolleret forsøg med Byetta hos patienter med utilstrækkelig glukosekontrol på trods af brugen af en Thiazolidinedion (TZD) eller en Thiazolidinedione plus Metformin
| Placebo BUD |
Byetta 10 mcg* BUD |
|
|---|---|---|
| ||
| I kombination med en TZD eller en TZD plus MET | ||
| Befolkning til hensigt at behandle (N) | 112 | 121 |
| HbA1c (%), Betyde | ||
| Baseline | 7.9 | 7.9 |
| Skift i uge 16 | +0.1 | −0.8†|
| Proportion opnåelse af HbA1c≤7%c | 16.2% | 62.3%†|
| Kropsvægt (kg), gennemsnit | ||
| Baseline | 96.9 | 97.5 |
| Skift i uge 16 | −0.2 | −1.5†|
top
Indikationer og anvendelse
Byetta er indikeret som supplerende behandling til forbedring af glykæmisk kontrol hos patienter med type 2-diabetes mellitus, der tager metformin, en sulfonylurinstof, en thiazolidinedione, en kombination af metformin og en sulfonylurinstof eller en kombination af metformin og en thiazolidinedion, men har ikke opnået tilstrækkelig glykæmisk styring.
top
Kontraindikationer
Byetta er kontraindiceret til patienter med kendt overfølsomhed over for exenatid eller over for nogen af produktkomponenterne.
top
Forholdsregler
Generel
Byetta kan ikke erstatte insulin hos patienter, der kræver insulin. Byetta bør ikke anvendes til patienter med diabetes type 1 eller til behandling af diabetisk ketoacidose.
Patienter kan udvikle anti-exenatid-antistoffer efter behandling med Byetta, i overensstemmelse med de potentielt immunogene egenskaber ved protein- og peptidfarmaceutika. Patienter, der får Byetta, skal overholdes for tegn og symptomer på overfølsomhedsreaktioner.
Hos en lille del af patienterne kan dannelse af anti-exenatidantistoffer ved høje titere resultere i manglende opnåelse af tilstrækkelig forbedring af glykæmisk kontrol. Hvis der er forværret glykæmisk kontrol eller manglende opnåelse af målrettet glykæmisk kontrol, bør alternativ antidiabetisk behandling overvejes.
Den samtidige anvendelse af Byetta med insulin, D-phenylalaninderivater, meglitinider eller alfa-glucosidaseinhibitorer er ikke undersøgt.
Byetta anbefales ikke til brug hos patienter med nyresygdom i slutstadiet eller alvorlig nedsat nyrefunktion (kreatininclearance farmakokinetik, særlige populationer). Hos patienter med nyresygdom i slutstadiet, der fik dialyse, tolereredes enkeltdoser af Byetta 5 mcg ikke godt på grund af gastrointestinale bivirkninger.
Der har været sjældne, spontant rapporterede hændelser med ændret nyrefunktion, inklusive forøget serum kreatinin, nedsat nyrefunktion, forværret kronisk nyresvigt og akut nyresvigt, sommetider kræver hæmodialyse. Nogle af disse hændelser forekom hos patienter, der fik et eller flere farmakologiske midler, som vides at påvirke nyre funktion / hydratiseringsstatus og / eller hos patienter, der oplever kvalme, opkast og / eller diarré, med eller uden dehydrering. Samtidige midler inkluderede angiotensin-konverterende enzyminhibitorer, ikke-steroide antiinflammatoriske lægemidler og diuretika. Reversibilitet af ændret nyrefunktion er blevet observeret ved understøttende behandling og seponering af potentielt forårsagende midler, inklusive exenatid. Exenatid har ikke vist sig at være direkte nefrotoksisk i prækliniske eller kliniske studier.
Byetta er ikke undersøgt hos patienter med svær gastrointestinal sygdom, inklusive gastroparese. Dets anvendelse er ofte forbundet med gastrointestinale bivirkninger, herunder kvalme, opkast og diarré. Brug af Byetta anbefales derfor ikke til patienter med svær mave-tarm-sygdom. Udviklingen af svær mavesmerter hos en patient, der behandles med Byetta, bør undersøges, fordi det kan være et advarselssignal om en alvorlig tilstand.
hypoglykæmi
I de 30-ugers kontrollerede kliniske forsøg med Byetta blev en hypoglykæmi-episode registreret som en bivirkning, hvis Patienten rapporterede symptomer forbundet med hypoglykæmi med en ledsagende blodsukker DOSERING OG ADMINISTRATION).
Tabel 3: Forekomst (%) af hypoglykæmi * ved samtidig antidiabetisk terapi
| Byetta | Byetta | Byetta | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Placebo BUD |
5 mcg BUD |
10 mcg BUD |
Placebo BUD |
5 mcg BUD |
10 mcg BUD |
Placebo BUD |
5 mcg BUD |
10 mcg BUD |
|
| Med Metformin | Med en sulfonylurinstof | Med MET / SFU | |||||||
| Byetta og placebo blev administreret før morgen- og aftenmåltiderne. | |||||||||
| Forkortelser: BID, to gange dagligt; MET / SFU, metformin og et sulfonylurinstof. | |||||||||
| |||||||||
| N | 113 | 110 | 113 | 123 | 125 | 129 | 247 | 245 | 241 |
| hypoglykæmi | 5.3% | 4.5% | 5.3% | 3.3% | 14.4% | 35.7% | 12.6% | 19.2% | 27.8% |
Når det blev brugt som tilføjelse til en thiazolidinedion, med eller uden metformin, var forekomsten af symptomatisk mild til moderat hypoglykæmi med Byetta 11% sammenlignet med 7% med placebo.
Byetta ændrede ikke de modregulerende hormonsvar på insulininduceret hypoglykæmi i en randomiseret, dobbeltblind, kontrolleret undersøgelse hos raske forsøgspersoner.
Oplysninger til patienter
Patienter skal informeres om de potentielle risici ved Byetta. Patienter bør også informeres fuldt ud om selvledelsespraksis, herunder vigtigheden af korrekt opbevaring af Byetta, injektion teknik, tidspunkt for dosering af Byetta samt samtidig oral medicin, overholdelse af måltidsplanlægning, regelmæssig fysisk aktivitet, periodisk blodsukkerovervågning og HbA1c-test, genkendelse og håndtering af hypoglykæmi og hyperglykæmi og vurdering af diabetes komplikationer.
Patienter bør rådes til at informere deres læger, hvis de er gravide eller har til hensigt at blive gravide.
Hver dosis Byetta bør administreres som en SC-injektion i låret, maven eller overarmen når som helst inden for 60-minutters periode før morgen- og aftenmåltider (eller før de to hovedmåltider på dagen, ca. 6 timer eller mere) en del). Byetta bør ikke administreres efter et måltid. Hvis man glemmer en dosis, skal behandlingsregimet genoptages som foreskrevet med den næste planlagte dosis.
Risikoen for hypoglykæmi øges, når Byetta anvendes i kombination med et middel, der inducerer hypoglykæmi, såsom en sulfonylurinstof. Symptomerne, behandlingen og betingelserne, der disponerer for udvikling af hypoglykæmi, skal forklares til patienten. Mens patientens sædvanlige instruktioner til håndtering af hypoglykæmi ikke behøver at blive ændret, skal disse instruktioner være gennemgået og forstærket ved initiering af Byetta-behandling, især når det administreres samtidig med et sulfonylurinstof (se FORHOLDSREGLER, Hypoglykæmi).
Patienter bør informeres om, at behandling med Byetta kan resultere i en nedsat appetit og mad indtagelse og / eller kropsvægt, og at der ikke er behov for at modificere doseringsregimet på grund af sådan virkninger. Behandling med Byetta kan også resultere i kvalme, især ved påbegyndelse af terapi (se BIVIRKNINGER).
Patienten skal læse indsatsen "Information til patienten" og brugervejledningen til pen, inden behandling med Byetta startes og gennemgå dem, hver gang receptet genpåfyldes. Patienten skal instrueres i korrekt brug og opbevaring af pennen, idet det understreges, hvordan og hvornår man skal sætte en ny pen op, og bemærke, at kun et installationstrin er nødvendigt ved første brug. Patienten bør rådes om ikke at dele pen og nåle.
Patienter skal informeres om, at penneåle ikke er inkluderet i pennen og skal købes separat. Patienter bør informeres om, hvilken nålelængde og måler, der skal bruges.
Lægemiddelinteraktioner
Virkningen af Byetta på langsom gastrisk tømning kan reducere omfanget og hastigheden af absorption af oralt indgivne lægemidler. Byetta bør bruges med forsigtighed til patienter, der får oral medicin, der kræver hurtig absorption af mave-tarmkanalen. Til orale medicin, der er afhængige af tærskelkoncentrationer for effektivitet, såsom antikonceptiva og antibiotika, bør patienter rådes til at tage disse lægemidler mindst 1 time før Byetta injektion. Hvis sådanne lægemidler skal administreres sammen med mad, skal patienter rådes til at tage dem med et måltid eller en snack, når Byetta ikke administreres. Effekten af Byetta på absorption og effektivitet af orale prævention er ikke blevet karakteriseret.
Warfarin
I et kontrolleret klinisk farmakologisk studie hos raske frivillige blev der observeret en forsinkelse i warfarin Tmax på ca. 2 timer, når warfarin blev indgivet 30 minutter efter Byetta. Der blev ikke observeret klinisk relevante effekter på Cmax eller AUC. Siden markedsintroduktion har der imidlertid været spontant rapporterede tilfælde af øget INR (International Normalised Ratio) med samtidig brug af warfarin og Byetta, undertiden forbundet med blødende.
Karcinogenese, mutagenese, forringelse af fertilitet
En 104-ugers kræftfremkaldelsesundersøgelse blev udført hos han- og hunrotter i doser på 18, 70 eller 250 mcg / kg / dag indgivet ved bolus SC-injektion. Godartede thyreoidea-celle-adenomer blev observeret i hunrotter ved alle exenatiddoser. Forekomsten hos hunrotter var 8% og 5% i de to kontrolgrupper og 14%, 11% og 23% i grupper med lav, mellem- og højdosis med systemisk eksponering på henholdsvis 5, 22 og 130 gange den menneskelige eksponering, der er resultatet af den maksimale anbefalede dosis på 20 mcg / dag, baseret på plasmaområdet under kurven (AUC).
I et 104-ugers karcinogenicitetsundersøgelse hos mus i doser på 18, 70 eller 250 mcg / kg / dag indgivet ved bolus SC-injektion blev der ikke observeret tegn på tumorer ved doser op til 250 mcg / kg / dag, en systemisk eksponering op til 95 gange den menneskelige eksponering som følge af den maksimale anbefalede dosis på 20 mcg / dag, baseret på AUC.
Exenatid var ikke mutagent eller klastogent, med eller uden metabolisk aktivering, i Ames-bakteriemutagenicitetsassayet eller kromosomalt afvigelsesassay i kinesiske hamster-ovarieceller. Exenatid var negativt i in vivo-mikronukleusanalyse.
I musefrugterundersøgelser med SC-doser på 6, 68 eller 760 mcg / kg / dag blev mænd behandlet i 4 uger før til og gennem parring og kvinder blev behandlet 2 uger før og gennem parring indtil drægtighedsdag 7. Der blev ikke observeret nogen bivirkning på fertiliteten ved 760 mcg / kg / dag, en systemisk eksponering 390 gange den menneskelige eksponering som følge af den maksimale anbefalede dosis på 20 mcg / dag, baseret på AUC.
Graviditet
Graviditet kategori C
Exenatid har vist sig at forårsage reduceret føtal og neonatal vækst og skeletvirkninger hos mus kl systemisk eksponering 3 gange den menneskelige eksponering som følge af den anbefalede maksimale dosis på 20 mcg / dag, baseret på AUC. Exenatid har vist sig at forårsage skeletvirkninger hos kaniner ved systemisk eksponering 12 gange den menneskelige eksponering som følge af den maksimale anbefalede dosis på 20 mg / dag, baseret på AUC. Der er ingen tilstrækkelige og godt kontrollerede studier på gravide kvinder. Byetta bør kun bruges under graviditet, hvis den potentielle fordel retfærdiggør den potentielle risiko for fosteret.
Hos hunmus, der fik SC-doser på 6, 68 eller 760 mcg / kg / dag, der startede 2 uger før og igennem parring indtil drægtighedsdag 7, var der ingen negative føtal virkninger i doser op til 760 mcg / kg / dag, systemisk eksponering op til 390 gange den menneskelige eksponering som følge af den maksimale anbefalede dosis på 20 mcg / dag, baseret på AUC.
Hos gravide mus, der fik SC-doser på 6, 68, 460 eller 760 mcg / kg / dag fra drægtighedsdag 6 til 15 (organogenese), ganespalte (nogle med huller) og uregelmæssig skelet Ossifikation af ribben og kraniet knogler blev observeret ved 6 mcg / kg / dag, en systemisk eksponering 3 gange den menneskelige eksponering som følge af den maksimale anbefalede dosis på 20 mcg / kg / dag, baseret på AUC.
Hos gravide kaniner, der fik SC-doser på 0,2, 2, 22, 156 eller 260 mcg / kg / dag fra drægtighedsdag 6 til 18 (organogenese), uregelmæssig skelet Ossifikationer blev observeret ved 2 mcg / kg / dag, en systemisk eksponering 12 gange den humane eksponering som følge af den maksimale anbefalede dosis på 20 mcg / dag, baseret på AUC.
Hos gravide mus, der fik SC-doser på 6, 68 eller 760 mcg / kg / dag fra drægtighedsdag 6 til laktationsdag 20 (fravænning), blev der observeret et øget antal neonatale dødsfald på fødselsdage 2-4 i dæmninger givet 6 mcg / kg / dag, en systemisk eksponering 3 gange den menneskelige eksponering som følge af den maksimale anbefalede dosis på 20 mcg / dag, baseret på AUC.
Sygeplejerske mødre
Det vides ikke, om exenatid udskilles i modermælk. Mange lægemidler udskilles i modermælk, og på grund af potentialet for klinisk signifikante bivirkninger hos ammende spædbørn fra exenatid, en beslutning der skal foretages, om man skal afbryde produktionen af mælk til konsum eller afbryde lægemidlet under hensyntagen til lægemidlets betydning for ammende kvinde. Undersøgelser med ammende mus har vist, at exenatid er til stede i lave koncentrationer i mælk (mindre end eller lig med 2,5% af koncentrationen i moders plasma efter subkutan dosering). Der skal udvises forsigtighed, når Byetta administreres til en ammende kvinde.
Pædiatrisk brug
Byetta's sikkerhed og effektivitet er ikke blevet fastlagt hos pædiatriske patienter.
Geriatrisk brug
Byetta blev undersøgt hos 282 patienter 65 år eller ældre og hos 16 patienter 75 år eller ældre. Der blev ikke observeret forskelle i sikkerhed eller effektivitet mellem disse patienter og yngre patienter.
top
Bivirkninger
Brug sammen med metformin og / eller en sulfonylurinstof
I de tre 30-ugers kontrollerede forsøg med Byetta-tilføjelse til metformin og / eller sulfonylurinstof, var bivirkninger med en forekomst på 5% (ekskl. Hypoglykæmi; se Tabel 3), der forekom hyppigere hos Byetta-behandlede patienter sammenlignet med placebo-behandlede patienter er opsummeret i tabel 4.
Tabel 4: Hyppige bivirkninger til behandling - Emergent (â € 5% forekomst og større forekomst med byetta-behandling) ekskl. Hypoglykæmi *
| Placebo-bud N = 483 % |
Alle Byetta-bud N = 963 % |
|
|---|---|---|
| ||
| Kvalme | 18 | 44 |
| Opkastning | 4 | 13 |
| Diarré | 6 | 13 |
| Føler Jittery | 4 | 9 |
| svimmelhed | 6 | 9 |
| Hovedpine | 6 | 9 |
| Dyspepsi | 3 | 6 |
Bivirkningerne forbundet med Byetta var generelt milde til moderate i intensitet. Den mest hyppigt rapporterede bivirkning, mild til moderat kvalme, forekom på en dosisafhængig måde. Med fortsat terapi faldt hyppigheden og sværhedsgraden over tid hos de fleste af de patienter, der oprindeligt oplevede kvalme. Bivirkninger rapporteret hos 1,0 til <5,0% af patienterne, der fik Byetta, og rapporterede hyppigere end med placebo inkluderet asteni (for det meste rapporteret som svaghed), nedsat appetit, gastroøsofageal reflukssygdom og hyperhidrosis. Patienter i ekstensionsundersøgelserne efter 52 uger oplevede lignende typer bivirkninger observeret i de 30 ugers kontrollerede forsøg.
Incidensen af abstinens på grund af bivirkninger var 7% for Byetta-behandlede patienter og 3% for placebo-behandlede patienter. De mest almindelige bivirkninger, der førte til abstinens hos Byetta-behandlede patienter, var kvalme (3% af patienterne) og opkast (1%). For placebo-behandlede patienter trak <1% sig tilbage på grund af kvalme og 0% på grund af opkast.
Brug sammen med en thiazolidinedion
I den 16-ugers placebokontrolleret undersøgelse af Byetta tilføjelse til en thiazolidinedion, med eller uden metformin, forekomsten og typen af andre observerede bivirkninger svarede til dem, der blev set i de 30-ugers kontrollerede kliniske forsøg med metformin og / eller a sulfonylurinstof. Der blev ikke rapporteret om alvorlige bivirkninger i placebo-armen. To alvorlige bivirkninger, nemlig brystsmerter (der førte til abstinens) og kronisk overfølsomhedspneumonitis, blev rapporteret i Byetta-armen.
Incidensen af abstinens på grund af bivirkninger var 16% (19/121) for Byetta-behandlede patienter og 2% (2/112) for placebo-behandlede patienter. De mest almindelige bivirkninger, der førte til abstinens hos Byetta-behandlede patienter, var kvalme (9%) og opkast (5%). For placebo-behandlede patienter trak <1% sig tilbage på grund af kvalme. Chills (n = 4) og reaktioner på injektionsstedet (n = 2) forekom kun hos patienter, der blev behandlet af Byetta. De to patienter, der rapporterede en reaktion på injektionsstedet, havde høje titere af anti-exenatid-antistof.
Spontane data
Siden markedsføringen af Byetta er følgende yderligere bivirkninger rapporteret. Da disse begivenheder rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagsforhold til eksponering af lægemiddel.
Generelt: reaktioner på injektionsstedet; smagsforstyrrelser; somnolens, INR steg med samtidig brug af warfarin (nogle rapporter forbundet med blødning).
Allergi / overfølsomhed: generaliseret kløe og / eller urticaria, makulært eller papulært udslæt, angioødem; sjældne rapporter om anafylaktisk reaktion.
Gastrointestinal: kvalme, opkast og / eller diarré, der resulterer i dehydrering; abdominal distension, mavesmerter, udbrud, forstoppelse, flatulens, akut pancreatitis.
Nyre- og urinforstyrrelser: ændret nyrefunktion, inklusive akut nyresvigt, forværret kronisk nyresvigt, nedsat nyrefunktion, øget serumkreatinin (se FORHOLDSREGLER).
immunogenicitet
I overensstemmelse med de potentielt immunogene egenskaber ved protein- og peptidlægemidler kan patienter udvikle anti-exenatid-antistoffer efter behandling med Byetta. Hos de fleste patienter, der udvikler antistoffer, formindskes antistoftitere med tiden.
I de 30-ugers kontrollerede forsøg med Byetta-tilføjelse til metformin og / eller sulfonylurinstof havde 38% af patienterne antistofantistoffer med lav titer efter 30 uger. For denne gruppe var niveauet for glykæmisk kontrol (HbA1c) generelt sammenligneligt med det, der blev observeret i dem uden antistoftitere. Yderligere 6% af patienterne havde højere titerantistoffer efter 30 uger. I ca. halvdelen af disse 6% (3% af de samlede patienter, der fik Byetta i de 30-ugers kontrollerede studier), blev den glykæmiske respons på Byetta svækket; resten havde en glykæmisk respons, der var sammenlignelig med den hos patienter uden antistoffer.
I det 16-ugers forsøg med Byetta-tilføjelse til thiazolidinediones, med eller uden metformin, havde 9% af patienterne højere titerantistoffer efter 16 uger. Sammenlignet med patienter, der ikke udviklede antistoffer mod Byetta, blev gennemsnitligt den glykæmiske respons hos patienter med højere titerantistoffer dæmpet.
Patientens glykæmiske respons på Byetta skal overvåges. Hvis der er forværret glykæmisk kontrol eller manglende opnåelse af målrettet glykæmisk kontrol, bør alternativ antidiabetisk behandling overvejes.
top
overdosering
I en klinisk undersøgelse af Byetta oplevede tre patienter med type 2-diabetes hver en enkelt overdosis på 100 mcg SC (10 gange den maksimale anbefalede dosis). Virkningerne af overdoserne omfattede alvorlig kvalme, kraftig opkast og hurtigt faldende koncentration af blodsukker. En af de tre patienter oplevede svær hypoglykæmi, som krævede parenteral glukoseadministration. De tre patienter kom sig uden komplikationer. I tilfælde af overdosering skal passende understøttende behandling påbegyndes i henhold til patientens kliniske tegn og symptomer.
top
Dosering og administration
Byetta-behandling bør påbegyndes med 5 mg pr. Dosis, der indgives to gange dagligt når som helst inden for 60 minutter periode før morgen- og aftenmåltider (eller før de to hovedmåltider på dagen, ca. 6 timer eller mere) en del). Byetta bør ikke administreres efter et måltid. Baseret på klinisk respons kan dosis af Byetta øges til 10 mcg to gange dagligt efter 1 måned af behandlingen. Hver dosis skal administreres som en SC-injektion i låret, maven eller overarmen.
Byetta anbefales til brug hos patienter med type 2 diabetes mellitus, der allerede modtager metformin, en sulfonylurinstof, en thiazolidinedion, en kombination af metformin og en sulfonylurinstof eller en kombination af metformin og en thiazolidinedion og har suboptimal glykæmisk kontrol. Når Byetta sættes til metformin- eller thiazolidinedion-terapi, kan den aktuelle dosis af metformin eller thiazolidinedione fortsættes da det er usandsynligt, at dosis metformin eller thiazolidinedion kræver justering på grund af hypoglykæmi, når det bruges sammen med Byetta. Når Byetta føjes til sulfonylurinstofterapi, kan en reduktion i dosis sulfonylurinstof overvejes for at reducere risikoen for hypoglykæmi (se FORHOLDSREGLER, Hypoglykæmi).
Byetta er en klar og farveløs væske og bør ikke anvendes, hvis der vises partikler, eller hvis opløsningen er uklar eller farvet. Byetta bør ikke bruges efter udløbsdatoen. Der foreligger ingen data om sikkerheden eller effekten af intravenøs eller intramuskulær injektion af Byetta.
top
Opbevaring
Før første brug skal Byetta opbevares kølet ved 2 ° C til 8 ° C. Efter første brug kan Byetta holdes ved en temperatur, der ikke må overstige 25 ° C (77 ° F). Frys ikke. Brug ikke Byetta, hvis den er frosset. Byetta skal beskyttes mod lys. Pennen skal kasseres 30 dage efter første brug, selvom der er noget stof tilbage i pennen.
top
Hvordan leveres
Byetta leveres som en steril opløsning til subkutan injektion indeholdende 250 mcg / ml exenatid. Følgende pakker er tilgængelige:
5 mcg pr. Dosis, 60 doser, 1,2 ml forudfyldt pen NDC 66780-210-07
10 mcg pr. Dosis, 60 doser, 2,4 ml forudfyldt pen NDC 66780-210-08
KUN Rx
Fremstillet til Amylin Pharmaceuticals, Inc., San Diego, CA 92121
Markedsført af Amylin Pharmaceuticals, Inc. og Eli Lilly og Company
1-800-868-1190
http://www.Byetta.com
Byetta er et registreret varemærke tilhørende Amylin Pharmaceuticals, Inc.
© 2007 Amylin Pharmaceuticals, Inc. Alle rettigheder forbeholdes.
sidst opdateret 09/2007
Byetta (Exenatide) Patientinformation (på almindeligt engelsk)
Detaljeret information om tegn, symptomer, årsager, behandling af diabetes
Oplysningerne i denne monografi er ikke beregnet til at dække alle mulige anvendelser, instruktioner, forholdsregler, medikamentinteraktion eller ugunstige virkninger. Denne information er generaliseret og er ikke beregnet til specifik medicinsk rådgivning. Hvis du har spørgsmål til de lægemidler, du tager eller ønsker flere oplysninger, skal du kontakte din læge, apotek eller sygeplejerske.
tilbage til: Gennemse alle medicin mod diabetes

