Starlix til behandling af diabetes
Brand name: Starlix
Generisk navn: nateglinide tabletter
Indhold:
Beskrivelse
Klinisk farmakologi
Kliniske studier
Indikationer og anvendelse
Kontraindikationer
Forholdsregler
Bivirkninger
overdosering
Dosering og administration
Hvordan leveres
Starlix, nateglinide, fuld patientinformation (på almindeligt engelsk)
Beskrivelse
Starlix® (nateglinide) er et oralt antidiabetisk middel, der bruges til behandling af type 2-diabetes mellitus [også kendt som ikke-insulinafhængig diabetes mellitus (NIDDM) eller voksen-debut diabetes]. Starlix, (-) - N - [(trans-4-isopropylcyclohexan) carbonyl] -D-phenylalanin, er strukturelt ikke forbundet med de orale insulinsekretagoger med sulfonylurinstof.
Strukturformlen er som vist
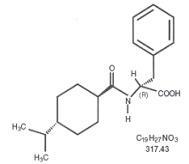
Nateglinide er et hvidt pulver med en molekylvægt på 317,43. Den er frit opløselig i methanol, ethanol og chloroform, opløselig i ether, sparsomt opløselig i acetonitril og octanol og praktisk talt uopløselig i vand. Starlix biconvex-tabletter indeholder 60 mg eller 120 mg nateglinid til oral administration.
Inaktive ingredienser: kolloid siliciumdioxid, natriumcroskarmellose, hydroxypropylmethylcellulose, jernoxider (rød eller gul), lactosemonohydrat, magnesiumstearat, mikrokrystallinsk cellulose, polyethylenglycol, povidon, talkum og titan dioxid.
top
Klinisk farmakologi
Handlingsmekanisme
Nateglinide er et aminosyrederivat, der sænker blodsukkerniveauet ved at stimulere insulinudskillelse fra bugspytkirtlen. Denne handling er afhængig af fungerende beta-celler i bugspytkirtlen. Nateglinide interagerer med den ATP-følsomme kalium (K + ATP) kanal på pancreasbetaceller. Den efterfølgende depolarisering af beta-cellen åbner calciumkanalen og producerer calciumtilstrømning og insulinsekretion. Omfanget af insulinfrigivelse er glukoseafhængig og formindskes ved lave glukoseniveauer. Nateglinide er meget vævsselektiv med lav affinitet for hjerte- og knoglemuskler.
Farmakokinetik
absorption
Efter oral indgivelse umiddelbart før et måltid absorberes nateglinid hurtigt med den gennemsnitlige maksimale plasmakoncentration af plasma (Cmax), der normalt forekommer inden for 1 time (Tmax) efter dosering. Når det administreres til patienter med type 2-diabetes i doseringsområdet 60 mg til 240 mg tre gange om dagen for en uge, demonstrerede nateglinid lineær farmakokinetik for både AUC (område under tid / plasmakoncentrationskurven) og Cmax. Tmax viste sig også at være uafhængig af dosis i denne patientpopulation. Den absolutte biotilgængelighed vurderes at være ca. 73%. Når det gives med eller efter måltider, forbliver omfanget af nateglinidabsorption (AUC) ikke påvirket. Der er imidlertid en forsinkelse i absorptionshastigheden, der er karakteriseret ved et fald i Cmax og en forsinkelse i tiden til maksimal plasmakoncentration (Tmax). Plasmaprofiler er kendetegnet ved flere plasmakoncentrationstoppe, når nateglinid administreres under fastebetingelser. Denne virkning mindskes, når nateglinid tages før et måltid.
Fordeling
Baseret på data efter intravenøs (IV) administration af nateglinid, estimeres distributionsvolumet for nateglinid til steady-state til at være ca. 10 liter hos raske individer. Nateglinid er i vid udstrækning bundet (98%) til serumproteiner, primært serumalbumin, og i mindre grad Î ± 1 surt glycoprotein. Omfanget af serumproteinbinding er uafhængigt af lægemiddelkoncentration i testområdet fra 0,1-10 ug / ml.
Metabolisme
Nateglinid metaboliseres af oxidase-systemet med blandet funktion inden eliminering. De vigtigste metaboliseringsveje er hydroxylering efterfulgt af glucuronid-konjugering. De vigtigste metabolitter er mindre potente antidiabetika end nateglinid. Mindre isoprenmetabolit har en styrke, der svarer til den af moderforbindelsen nateglinid.
In vitro-data viser, at nateglinid overvejende metaboliseres af cytochrome P450-isoenzymer CYP2C9 (70%) og CYP3A4 (30%).
udskillelse
Nateglinide og dets metabolitter elimineres hurtigt og fuldstændigt efter oral administration. Inden for 6 timer efter dosering blev ca. 75% af det indgivne 14C-nateglinid genvundet i urinen. 85% af 14C-nateglinid blev udskilt i urinen med yderligere 10% elimineret i fæces. Cirka 16% af 14C-nateglinid blev udskilt i urinen som moderforbindelse. I alle undersøgelser af raske frivillige og patienter med type 2-diabetes faldt nateglinid-plasmakoncentrationer hurtigt med en gennemsnitlig eliminationshalveringstid på ca. 1,5 timer. I overensstemmelse med denne korte eliminationshalveringstid var der ingen tilsyneladende akkumulering af nateglinid efter multiple doseringer på op til 240 mg tre gange dagligt i 7 dage.
Lægemiddelinteraktioner
In vitro-undersøgelser af lægemiddelmetabolisme indikerer, at Starlix overvejende metaboliseres af cytochrome P450-isozymet CYP2C9 (70%) og i mindre grad CYP3A4 (30%). Starlix er en potentiel hæmmer af CYP2C9 isoenzym in vivo som indikeret af dets evne til at hæmme in vitro metabolisme af tolbutamid. Inhibering af metaboliske CYP3A4-reaktioner blev ikke påvist i in vitro-eksperimenter.
Glyburide: I en randomiseret, multiple-dosis crossover-undersøgelse var patienter med type 2-diabetes administreret 120 mg Starlix tre gange om dagen før måltider i 1 dag i kombination med glyburid 10 mg dagligt. Der var ingen klinisk relevante ændringer i farmakokinetikken for et hvilket som helst middel.
Metformin: Når Starlix 120 mg tre gange dagligt før måltiderne blev administreret i kombination med metformin 500 mg tre gange dagligt for patienter med type 2-diabetes var der ingen klinisk relevante ændringer i farmakokinetikken for nogen af disse agent.
Digoxin: Når Starlix 120 mg før måltider blev administreret i kombination med en enkelt 1 mg dosis på digoxin til raske frivillige, var der ingen klinisk relevante ændringer i farmakokinetikken for nogen af disse agent.
Warfarin: Når raske forsøgspersoner blev indgivet Starlix 120 mg tre gange dagligt før måltider i fire dage i kombination med en enkelt dosis warfarin 30 mg på dag 2 var der ingen ændringer i farmakokinetikken for agent. Prothrombintid blev ikke påvirket.
Diclofenac: Administration af morgen- og frokostdoser af Starlix 120 mg i kombination med en enkelt 75 mg dosis diclofenac hos raske frivillige resulterede i ingen signifikante ændringer i farmakokinetikken for nogen af disse agent.
Særlige befolkninger
Geriatrisk: Alder påvirkede ikke de farmakokinetiske egenskaber ved nateglinid. Derfor er ingen dosisjusteringer nødvendige for ældre patienter.
Køn: Der blev ikke observeret klinisk signifikante forskelle i nateglinid farmakokinetik mellem mænd og kvinder. Derfor er ingen dosisjustering baseret på køn nødvendig.
Rase: Resultater af en farmakokinetisk populationsanalyse inklusive individer af kaukasisk, sort og anden etnisk oprindelse antyder, at race har ringe indflydelse på nateglinids farmakokinetik.
Nedsat nyrefunktion: Sammenlignet med sunde matchede forsøgspersoner, patienter med type 2-diabetes og moderat til alvorlig nyreinsufficiens (CrCl 15-50 ml / min) ikke på dialyse viste lignende tilsyneladende clearance, AUC og Cmax. Patienter med type 2-diabetes og nyresvigt ved dialyse udviste reduceret samlet lægemiddeleksponering. Imidlertid oplevede hæmodialysepatienter reduktioner i plasma-proteinbinding sammenlignet med de matchede raske frivillige.
Nedsat leverfunktion: Den maksimale og totale eksponering af nateglinid hos ikke-diabetiske forsøgspersoner med mild leverinsufficiens blev øget med 30% sammenlignet med matchede raske individer. Starlix® (nateglinide) bør anvendes med forsigtighed til patienter med kronisk leversygdom. (Se FORHOLDSREGLER, Nedsat leverfunktion.)
farmakodynamik
Starlix absorberes hurtigt og stimulerer pancreasinsekretion inden for 20 minutter efter oral administration. Når Starlix doseres tre gange dagligt før måltider, sker der en hurtig stigning i plasmainsulin, med højeste niveau ca. 1 time efter dosering og et fald til baseline med 4 timer efter dosering.
I et dobbeltblindt, kontrolleret klinisk forsøg, hvor Starlix blev administreret før hver af tre måltider blev plasmaglukoseniveauer bestemt over en 12-timers dagtidsperiode efter 7 uger af behandling. Starlix blev indgivet 10 minutter før måltider. Måltiderne var baseret på standardmenuer til vedligeholdelse af diabetisk vægt med det samlede kalorieindhold baseret på hvert enkelt persons højde. Starlix producerede statistisk signifikante fald i fastende og postprandial glycæmi sammenlignet med placebo.
top
Kliniske studier
I alt 3.566 patienter blev randomiseret i ni dobbeltblinde, placebo- eller aktiv-kontrollerede studier 8 til 24 uger i varighed for at evaluere sikkerheden og effekten af Starlix® (nateglinide). 3.513 patienter havde effektværdier ud over baseline. I disse undersøgelser blev Starlix indgivet op til 30 minutter før hver af tre hovedmåltider dagligt.
Starlix® monoterapi sammenlignet med Placebo
I en randomiseret, dobbeltblind, placebokontrolleret 24-ugers undersøgelse blev patienter med type 2-diabetes med HbA1C â € 6,8% på diæt alene blev randomiseret til at modtage enten Starlix (60 mg eller 120 mg tre gange dagligt før måltider) eller placebo. Baseline HbA1C varierede fra 7,9% til 8,1%, og 77,8% af patienterne var tidligere ubehandlet med oral antidiabetisk behandling. Patienter, der tidligere blev behandlet med antidiabetika, var nødt til at indstille denne medicin i mindst 2 måneder før randomisering. Tilsætningen af Starlix før måltider resulterede i statistisk signifikante reduktioner i middel HbA1C og gennemsnitlig fastende plasmaglukose (FPG) sammenlignet med placebo (se tabel 1). Reduktionerne i HbA1C og FPG var ens for patienter, der ikke har været til og dem, der tidligere var udsat for antidiabetika.
I denne undersøgelse blev der rapporteret om en episode af svær hypoglykæmi (plasmaglukose <36 mg / dL) hos en patient behandlet med Starlix 120 mg tre gange dagligt før måltider. Ingen patienter oplevede hypoglykæmi, som krævede hjælp fra tredjepart. Patienter behandlet med Starlix havde statistisk signifikante gennemsnitlige stigninger i vægt sammenlignet med placebo (se tabel 1).
I en anden randomiseret, dobbeltblind, 24-ugers, aktiv og placebo-kontrolleret undersøgelse blev patienter med type 2-diabetes randomiseret til at modtage Starlix (120 mg tre gange dagligt før måltider), metformin 500 mg (tre gange dagligt), en kombination af Starlix 120 mg (tre gange dagligt før måltider) og metformin 500 mg (tre gange dagligt), eller placebo. Baseline HbA1C varierede fra 8,3% til 8,4%. Syvoghalvfjerds procent af patienterne var tidligere ubehandlet med oral antidiabetisk behandling. Starlix monoterapi resulterede i signifikante reduktioner i middel HbA1C og gennemsnitlig FPG sammenlignet med placebo, der svarede til resultaterne fra undersøgelsen rapporteret ovenfor (se tabel 2).
Tabel 1: Endepunktresultater for en 24-ugers fast dosisundersøgelse af Starlix® monoterapi
|
Placebo |
Starlix® 60 mg tre gange daglige før måltider |
Starlix® 120 mg tre gange daglige før måltider |
|
| HbA1C (%) | N = 168 | N = 167 | N = 168 |
| Baseline (gennemsnit) | 8.0 | 7.9 | 8.1 |
| Skift fra basislinje (gennemsnit) | +0.2 | -0.3 | -0.5 |
| Forskel fra placebo (middelværdi) | -0.5 -en | -0.7 -en | |
| FPG (mg / dL) | N = 172 | N = 171 | N = 169 |
| Baseline (gennemsnit) | 167.9 | 161.0 | 166.5 |
| Skift fra basislinje (gennemsnit) | +9.1 | +0.4 | -4.5 |
| Forskel fra placebo (middelværdi) | -8.7 -en | -13.6 -en | |
| Vægt (kg) | N = 170 | N = 169 | N = 166 |
| Baseline (gennemsnit) | 85.8 | 83.7 | 86.3 |
| Skift fra basislinje (gennemsnit) | -0.7 | +0.3 | +0.9 |
| Forskel fra placebo (middelværdi) | +1.0 -en | +1.6 -en |
en p-værdi â ‰ ¤ 0,004
Starlix® monoterapi sammenlignet med andre orale antidiabetika
Glyburide
I et 24-ugers, dobbeltblindt, aktivt kontrolleret forsøg blev patienter med type 2-diabetes, der havde været på en sulfonylurinstof i â 3 måneder, og som havde en basislinje HbA1C - 6,5% blev randomiseret til at modtage Starlix (60 mg eller 120 mg tre gange dagligt før måltider) eller glyburid 10 mg en gang daglige. Patienter randomiseret til Starlix havde signifikante stigninger i gennemsnitligt HbA1C og gennemsnitligt FPG ved endepunkt sammenlignet med patienter, der blev randomiseret til glyburid.
Metformin
I en anden randomiseret, dobbeltblind, 24-ugers, aktiv og placebo-kontrolleret undersøgelse blev patienter med type 2-diabetes randomiseret til at modtage Starlix (120 mg tre gange dagligt før måltider), metformin 500 mg (tre gange dagligt), en kombination af Starlix 120 mg (tre gange dagligt før måltider) og metformin 500 mg (tre gange dagligt), eller placebo. Baseline HbA1C varierede fra 8,3% til 8,4%. Syvoghalvfjerds procent af patienterne var tidligere ubehandlet med oral antidiabetisk behandling. Reduktionerne i gennemsnitligt HbA1C og gennemsnitligt FPG ved slutpunkt med metformin-monoterapi var signifikant større end reduktionerne i disse variabler med Starlix monoterapi (se tabel 2). I forhold til placebo var Starlix-monoterapi forbundet med signifikante stigninger i middelvægt, hvorimod metformin-monoterapi var forbundet med signifikant fald i middelvægt. Blandt undergruppen af patienter, der ikke var til antidiabetisk terapi, var reduktionerne i middel HbA1C og gennemsnitlig FPG for Starlix monoterapi svarende til dem for metformin monoterapi (se tabel 2). Blandt undergruppen af patienter, der tidligere blev behandlet med andre antidiabetika, primært glyburid, HbA1C i Starlix monoterapi-gruppen steg lidt fra basislinjen, hvorimod HbA1C blev reduceret i metformin-monoterapigruppen (se tabel 2).
Starlix® kombinationsterapi
Metformin
I en anden randomiseret, dobbeltblind, 24-ugers, aktiv og placebo-kontrolleret undersøgelse blev patienter med type 2-diabetes randomiseret til at modtage Starlix (120 mg tre gange dagligt før måltider), metformin 500 mg (tre gange dagligt), en kombination af Starlix 120 mg (tre gange dagligt før måltider) og metformin 500 mg (tre gange dagligt), eller placebo. Baseline HbA1C varierede fra 8,3% til 8,4%. Syvoghalvfjerds procent af patienterne var tidligere ubehandlet med oral antidiabetisk behandling. Patienter, der tidligere blev behandlet med antidiabetika, var nødt til at afbryde medicinen i mindst 2 måneder før randomisering. Kombinationen af Starlix og metformin resulterede i statistisk signifikant større reduktioner i HbA1C og FPG sammenlignet med enten Starlix eller metformin monoterapi (se tabel 2). Starlix, alene eller i kombination med metformin, reducerede den prandiale glukosehøjde signifikant fra før måltid til 2 timer efter måltid sammenlignet med placebo og metformin alene.
I denne undersøgelse blev der rapporteret en episode af svær hypoglykæmi (plasmaglukose - 36 mg / dL) hos en patient, der fik kombination af Starlix og metformin og fire episoder med svær hypoglykæmi blev rapporteret hos en enkelt patient i metformin behandlingsarm. Ingen patienter oplevede en episode af hypoglykæmi, som krævede hjælp fra tredjepart. Sammenlignet med placebo var Starlix monoterapi forbundet med en statistisk signifikant stigning i vægt, mens der ikke blev observeret nogen signifikant ændring i vægt med kombineret Starlix- og metforminbehandling (se tabel 2).
I et andet 24-ugers, dobbeltblindt, placebokontrolleret forsøg blev patienter med type 2-diabetes med HbA1C - 6,8% efter behandling med metformin (â € 1500 mg dagligt i â € 1 måned) først indtastet ind i en fire ugers indkøringsperiode med metformin-monoterapi (2000 mg dagligt) og derefter randomiseret til at modtage Starlix (60 mg eller 120 mg tre gange dagligt før måltider) eller placebo ud over metformin. Kombinationsterapi med Starlix og metformin var forbundet med statistisk signifikant større reduktioner i HbA1C sammenlignet med metformin monoterapi (-0,4% og -0,6% for Starlix 60 mg og Starlix 120 mg plus metformin, henholdsvis).
Tabel 2: Endepunktresultater for en 24-ugers undersøgelse af Starlix® monoterapi og kombination med metformin
|
Placebo |
Starlix® 120 mg tre gange dagligt før måltider |
Metformin 500 mg tre gange daglige |
Starlix® 120 mg Før måltider plus Metformin * |
|
| HbA1C (%) | ||||
| Alle | N = 160 | N = 171 | N = 172 | N = 162 |
| Baseline (gennemsnit) | 8.3 | 8.3 | 8.4 | 8.4 |
| Skift fra basislinje (gennemsnit) | +0.4 | -0.4 bc | -0.8 c | -1.5 |
| Forskel fra placebo | -0.8 -en | -1.2 -en | -1.9 -en | |
| Nan-ve | N = 98 | N = 99 | N = 98 | N = 81 |
| Baseline (gennemsnit) | 8.2 | 8.1 | 8.3 | 8.2 |
| Skift fra basislinje (gennemsnit) | +0.3 | -0.7 c | -0.8 c | -1.6 |
| Forskel fra placebo | -1.0 -en | -1.1 -en | -1.9 -en | |
| Ikke-nan-ve | N = 62 | N = 72 | N = 74 | N = 81 |
| Baseline (gennemsnit) | 8.3 | 8.5 | 8.7 | 8.7 |
| Skift fra basislinje (gennemsnit) | +0.6 | +0.004 bc | -0.8 c | -1.4 |
| Forskel fra placebo | -0.6 -en | -1.4 -en | -2.0 -en | |
| FPG (mg / dL) | ||||
| Alle | N = 166 | N = 173 | N = 174 | N = 167 |
| Baseline (gennemsnit) | 194.0 | 196.5 | 196.0 | 197.7 |
| Skift fra basislinje (gennemsnit) | +8.0 | -13.1 bc | -30.0 c | -44.9 |
| Forskel fra placebo | -21.1 -en | -38.0 -en | -52.9 -en | |
| Vægt (kg) | ||||
| Alle | N = 160 | N = 169 | N = 169 | N = 160 |
| Baseline (gennemsnit) | 85.0 | 85.0 | 86.0 | 87.4 |
| Skift fra basislinje (gennemsnit) | -0.4 | +0.9 bc | -0.1 | +0.2 |
| Forskel fra placebo | +1.3 -en | +0.3 | +0.6 |
en p-værdi â ‰ ¤ 0,05 vs. placebo
b p-værdi â ‰ ¤ 0,03 vs. metformin
c p-værdi â ‰ ¤ 0,05 vs. kombination
* Metformin blev administreret tre gange dagligt
Rosiglitazon
En 24-ugers, dobbeltblind multicenter, placebokontrolleret undersøgelse blev udført hos patienter med type 2 diabetes ikke tilstrækkelig kontrolleret efter et terapeutisk respons på rosiglitazon monoterapi 8 mg daglige. Tilsætningen af Starlix (120 mg tre gange om dagen med måltider) var forbundet med statistisk signifikant større reduktioner i HbA1C sammenlignet med rosiglitazon monoterapi. Forskellen var -0,77% efter 24 uger. Den gennemsnitlige ændring i vægt fra basislinjen var ca. +3 kg for patienter behandlet med Starlix plus rosiglitazon mod ca. 1 kg for patienter behandlet med placebo plus rosiglitazon.
Glyburide
I en 12-ugers undersøgelse af patienter med type 2-diabetes utilstrækkeligt kontrolleret på 10 mg glyburid en gang dagligt tilsætning af Starlix (60 mg eller 120 mg tre gange dagligt før måltider) producerede ikke yderligere fordel.
top
Indikationer og anvendelse
Starlix® (nateglinide) er indikeret som et supplement til diæt og motion for at forbedre den glykæmiske kontrol hos voksne med type 2-diabetes mellitus.
top
Kontraindikationer
Starlix® (nateglinide) er kontraindiceret til patienter med:
1. Kendt overfølsomhed over for stoffet eller dets inaktive ingredienser.
2. Type 1 diabetes.
3. Diabetisk ketoacidose. Denne tilstand skal behandles med insulin.
top
Forholdsregler
Makrovaskulære resultater: Der har ikke været nogen kliniske undersøgelser, der viser, at der foreligger afgørende bevis for reduktion af makrovaskulær risiko med Starlix eller andre antidiabetika.
Hypoglykæmi: Alle orale blodglukosesænkende medikamenter, der absorberes systemisk, er i stand til at producere hypoglykæmi. Hyppigheden af hypoglykæmi er relateret til sværhedsgraden af diabetes, niveauet af glykæmisk kontrol og andre patientkarakteristika. Geriatriske patienter, underernærede patienter og patienter med binyre- eller hypofyseinsufficiens eller alvorlig nedsat nyrefunktion er mere modtagelige for glukosesænkende virkningen af disse behandlinger. Risikoen for hypoglykæmi kan øges ved anstrengende fysisk træning, indtagelse af alkohol, utilstrækkelig kaloriindtagelse på akut eller kronisk basis eller kombinationer med anden oral antidiabetikum midler. Hypoglykæmi kan være vanskeligt at genkende hos patienter med autonom neuropati og / eller dem, der bruger betablokkere. Starlix® (nateglinide) bør administreres før måltiderne for at reducere risikoen for hypoglykæmi. Patienter, der springer over måltider, bør også springe over deres planlagte dosis af Starlix for at reducere risikoen for hypoglykæmi.
Nedsat leverfunktion: Starlix bør anvendes med forsigtighed hos patienter med moderat til svær leversygdom, fordi sådanne patienter ikke er undersøgt.
Tab af glykæmisk kontrol
Forbigående tab af glykæmisk kontrol kan forekomme ved feber, infektion, traumer eller kirurgi. Insulinbehandling kan være nødvendig i stedet for Starlix-behandling på sådanne tidspunkter. Sekundær fiasko eller nedsat effektivitet af Starlix over en periode kan forekomme.
Oplysninger til patienter
Patienter skal informeres om de potentielle risici og fordele ved Starlix og om alternative behandlingsmetoder. Risici og håndtering af hypoglykæmi bør forklares. Patienterne skal instrueres om at tage Starlix 1 til 30 minutter før indtagelse af et måltid, men at springe over deres planlagte dosis, hvis de springer over måltidet, så risikoen for hypoglykæmi reduceres. Lægemiddelinteraktioner bør diskuteres med patienter. Patienter skal informeres om potentielle lægemiddelinteraktioner med Starlix.
Laboratorietest
Respons på behandlinger skal periodisk vurderes med glukoseværdier og HbA1C-niveauer.
Lægemiddelinteraktioner
Nateglinid er stærkt bundet til plasmaproteiner (98%), hovedsageligt albumin. In vitro-forskydningsundersøgelser med stærkt proteinbundne lægemidler, såsom furosemid, propranolol, captopril, nicardipin, pravastatin, glyburid, warfarin, phenytoin, acetylsalicylsyre, tolbutamid og metformin viste ingen indflydelse på omfanget af nateglinidprotein binding. Tilsvarende havde nateglinid ingen indflydelse på serumproteinbinding af propranolol, glyburid, nicardipin, warfarin, phenytoin, acetylsalicylsyre og tolbutamid in vitro. Imidlertid er en forsigtig evaluering af individuelle tilfælde berettiget i den kliniske indstilling.
Visse lægemidler, herunder ikke-steroide antiinflammatoriske midler (NSAID'er), salicylater, monoaminoxidaseinhibitorer og ikke-selektive beta-adrenerge-blokerende midler kan forstærke den hypoglykæmiske virkning af Starlix og andre orale antidiabetika. lægemidler.
Visse lægemidler, herunder thiazider, kortikosteroider, thyroidea-produkter og sympatomimetika, kan reducere den hypoglykæmiske virkning af Starlix og andre orale antidiabetika.
Når disse lægemidler administreres til eller udtages fra patienter, der får Starlix, skal patienten følges nøje for ændringer i glykæmisk kontrol.
Drug / mad interaktioner
Nateglinids farmakokinetik blev ikke påvirket af sammensætningen af et måltid (højt protein, fedt eller kulhydrat). De maksimale plasmaniveauer blev imidlertid signifikant reduceret, når Starlix blev indgivet 10 minutter før et flydende måltid. Starlix havde ingen virkning på gastrisk tømning hos raske individer som vurderet ved acetaminophen-test.
Karcinogenese / mutagenese / forringelse af fertilitet
Karcinogenicitet: En to-årig carcinogenicitetsundersøgelse i Sprague-Dawley-rotter blev udført med orale doser af nateglinid op til 900 mg / kg / dag, hvilket frembragte AUC-eksponeringer hos han- og hunrotter ca. 30 og 40 gange den humane terapeutiske eksponering med en anbefalet Starlix-dosis på 120 mg, tre gange dagligt før måltider. En to-årig carcinogenicitetsundersøgelse i B6C3F1-mus blev udført med orale doser nateglinid op til 400 mg / kg / dag, hvilket gav AUC-eksponering hos mandlige og hunmus ca. 10 og 30 gange den humane terapeutiske eksponering med en anbefalet Starlix-dosis på 120 mg, tre gange dagligt før måltider. Der blev ikke fundet noget bevis for en tumorigenisk respons hos hverken rotter eller mus.
Mutagenese: Nateglinid var ikke genotoksisk i in vitro Ames-test, muselymfomeassay, kromosomafvigelsesassay i kinesiske hamster-lungeceller eller i in vivo-musmikronukleustest.
Nedskrivning af fertilitet: Fertilitet blev ikke påvirket af administration af nateglinid til rotter i doser op til 600 mg / kg (ca. 16 gange den humane terapeutiske eksponering med en anbefalet Starlix-dosis på 120 mg tre gange dagligt før måltider).
Graviditet
Graviditet kategori C
Nateglinid var ikke teratogent hos rotter i doser op til 1000 mg / kg (ca. 60 gange den humane terapeutiske eksponering med en anbefalet Starlix-dosis på 120 mg, tre gange dagligt før måltider). Hos kaninen blev den embryonale udvikling påvirket negativt, og forekomsten af galdeblærenæsen eller lille galdeblære blev øget ved en dosis på 500 mg / kg (ca. 40 gange den humane terapeutiske eksponering med en anbefalet Starlix-dosis på 120 mg, tre gange dagligt før måltider). Der er ingen passende og godt kontrollerede studier på gravide kvinder. Starlix bør ikke bruges under graviditet.
Arbejdskraft og levering
Virkningen af Starlix på fødsel og levering hos mennesker er ikke kendt.
Sygeplejerske mødre
Undersøgelser med ammende rotter viste, at nateglinid udskilles i mælken; forholdet AUC0-48h i mælk til plasma var ca. 1: 4. I den peri- og postnatale periode var kropsvægterne lavere hos afkom af rotter administreret nateglinid ved 1000 mg / kg (ca. 60 gange den humane terapeutiske eksponering med en anbefalet Starlix-dosis på 120 mg, tre gange dagligt før måltider). Det vides ikke, om Starlix udskilles i modermælk. Da mange lægemidler udskilles i modermælk, bør Starlix ikke administreres til en ammende kvinde.
Pædiatrisk brug
Sikkerheden og effektiviteten af Starlix hos pædiatriske patienter er ikke fastlagt.
Geriatrisk brug
Der blev ikke observeret nogen forskelle i sikkerhed eller effekt af Starlix mellem patienter over 65 år og ældre og dem under 65 år. Imidlertid kan en større følsomhed hos nogle ældre personer over for Starlix-terapi ikke udelukkes.
top
Bivirkninger
I kliniske forsøg blev ca. 2.600 patienter med type 2-diabetes behandlet med Starlix® (nateglinide). Af disse blev ca. 1.335 patienter behandlet i 6 måneder eller længere og ca. 190 patienter i et år eller længere.
Hypoglykæmi var relativt usædvanligt i alle behandlingsarme i de kliniske forsøg. Kun 0,3% af Starlix-patienter seponerede på grund af hypoglykæmi. Gastrointestinale symptomer, især diarré og kvalme, var ikke mere almindelige hos patienter, der brugte kombinationen af Starlix og metformin, end hos patienter, der fik metformin alene. Ligeledes var perifert ødem ikke mere almindeligt hos patienter, der brugte kombinationen af Starlix og rosiglitazon end hos patienter, der fik rosiglitazon alene. Følgende tabel viser hændelser, der forekom hyppigere hos Starlix-patienter end placebo-patienter i kontrollerede kliniske studier.
Almindelige bivirkninger (â 2 ¥ hos Starlix®-patienter) i Starlix®-monoterapiforsøg (% af patienterne)
| Placebo | Starlix® | |
| N = 458 | N = 1441 | |
| Foretrukket periode | ||
| Øvre luftvejsinfektion | 8.1 | 10.5 |
| Rygsmerte | 3.7 | 4.0 |
| Influenzasymptomer | 2.6 | 3.6 |
| svimmelhed | 2.2 | 3.6 |
| artropati | 2.2 | 3.3 |
| Diarré | 3.1 | 3.2 |
| Tilfældig traume | 1.7 | 2.9 |
| bronkitis | 2.6 | 2.7 |
| hoste | 2.2 | 2.4 |
| hypoglykæmi | 0.4 | 2.4 |
Under markedsføring er der rapporteret om sjældne tilfælde af overfølsomhedsreaktioner som udslæt, kløe og urticaria. Tilsvarende er der rapporteret om gulsot, kolestatisk hepatitis og forhøjede leverenzymer.
Laboratorie abnormiteter
Urinsyre: Der var stigninger i gennemsnitlige urinsyreniveauer for patienter behandlet med Starlix alene, Starlix i kombination med metformin, metformin alene og glyburid alene. De respektive forskelle fra placebo var 0,29 mg / dL, 0,45 mg / dL, 0,28 mg / dL og 0,19 mg / dL. Den kliniske betydning af disse fund er ukendt.
top
overdosering
I en klinisk undersøgelse med patienter med type 2-diabetes blev Starlix® (nateglinide) administreret i stigende doser op til 720 mg om dagen i 7 dage, og der var ingen klinisk signifikante bivirkninger rapporteret. Der har ikke været nogen tilfælde af overdosering med Starlix i kliniske forsøg. Imidlertid kan en overdosis resultere i en overdrevet glukosesænkende virkning med udviklingen af hypoglykæmiske symptomer. Hypoglykæmiske symptomer uden tab af bevidsthed eller neurologiske fund bør behandles med oral glukose og justeringer i dosering og / eller måltidsmønstre. Alvorlige hypoglykæmiske reaktioner med koma, anfald eller andre neurologiske symptomer skal behandles med intravenøs glukose. Da nateglinid er stærkt proteinbundet, er dialyse ikke et effektivt middel til at fjerne det fra blodet.
top
Dosering og administration
Starlix® (nateglinide) bør tages 1 til 30 minutter før måltiderne.
Monoterapi og kombination med Metformin eller en Thiazolidinedione
Den anbefalede start- og vedligeholdelsesdosis af Starlix, alene eller i kombination med metformin eller en thiazolidinedion, er 120 mg tre gange dagligt før måltider.
60 mg dosis af Starlix, enten alene eller i kombination med metformin eller en thiazolidinedion, kan bruges til patienter, der er i nærheden af målet HbA1C, når behandlingen påbegyndes.
Dosering hos geriatriske patienter
Ingen særlige dosisjusteringer er normalt nødvendige. Imidlertid kan en større persons følsomhed over for Starlix-terapi ikke udelukkes.
Dosering ved nedsat nyre- og leverfunktion
Dosisjustering er ikke nødvendig hos patienter med mild til svær nyreinsufficiens eller hos patienter med mild leverinsufficiens. Dosering af patienter med moderat til alvorlig leverdysfunktion er ikke undersøgt. Derfor bør Starlix anvendes med forsigtighed til patienter med moderat til alvorlig leversygdom (se FORSIGTIGHEDSREGLER, Nedsat leverfunktion).
top
Hvordan leveres
Starlix® (nateglinide) tabletter
60 mg
Lyserød, rund, skråt kantet tablet med "Starlix" præget på den ene side og "60" på den anden.
Flasker på 100... NDC 0078-0351-05
120 mg
Gul, ovaloid tablet med "Starlix" præget på den ene side og "120" på den anden.
Flasker på 100... NDC 0078-0352-05
Opbevaring
Opbevares ved 25 ºC; udflugter tilladt til 15 ºC-30 ºC (59 ºF-86 ºF).
Dispenser i en tæt beholder, USP.
T2008-01
REV: JULI 2008
Fremstillet af:
Novartis Pharma Stein AG
Stein, Schweiz
Distribueret af:
Novartis Pharmaceuticals Corporation
East Hanover, New Jersey 07936
© Novartis
Sidst opdateret 07/2008
Starlix, nateglinide, fuld patientinformation (på almindeligt engelsk)
Detaljeret information om tegn, symptomer, årsager, behandling af diabetes
Oplysningerne i denne monografi er ikke beregnet til at dække alle mulige anvendelser, instruktioner, forholdsregler, medikamentinteraktion eller ugunstige virkninger. Denne information er generaliseret og er ikke beregnet til specifik medicinsk rådgivning. Hvis du har spørgsmål om de medicin, du tager eller ønsker mere information, skal du kontakte din læge, apotek eller sygeplejerske.
tilbage til: Gennemse alle medicin mod diabetes



