Iloperidone (fanapt) Fuld receptinformation
Brand name: Fanapt
Generisk navn: Iloperidone
Fanapt (Iloperidone) receptvejledning (PDF)
Indhold:
Boxed Advarsel
Indikationer og anvendelse
Dosering og administration
Kontraindikationer
Advarsler og forsigtighedsregler
Bivirkninger
Lægemiddelinteraktioner
Brug i specifikke befolkninger
Narkotikamisbrug og afhængighed
Overdosis
Beskrivelse
Klinisk farmakologi
Ikke-klinisk toksikologi
Kliniske studier
Hvordan leveres
Brintellix medicin guide
ADVARSEL: Øget MORTALITET I ELDERLIGE PASIENTER MED DEMENTIA-RELATERET PSYKOSE
Ældre patienter med demensrelateret psykose behandlet med antipsykotiske stoffer har en øget risiko for død. FANAPT er ikke godkendt til behandling af patienter med demensrelateret psykose.
Indikationer og anvendelse
FANAPT® er indiceret til behandling af skizofreni hos voksne.
Når han vælger blandt de alternative behandlinger, der er tilgængelige for denne tilstand, bør forskriveren overveje konstateringen af, at FANAPT er forbundet med forlængelse af QTc-intervallet. Forlængelse af QTc-intervallet er forbundet med nogle andre lægemidler med evnen til at forårsage torsade de pointes-type arytmi, en potentielt dødelig polymorf ventrikulær takykardi, som kan resultere i pludselig død. I mange tilfælde vil dette føre til konklusionen om, at andre stoffer først skulle prøves. Hvorvidt FANAPT vil forårsage torsade de pointes eller øge graden af pludselig død, vides endnu ikke.
Patienter skal titreres til en effektiv dosis FANAPT. Således kan kontrol af symptomer blive forsinket i løbet af de første 1 til 2 uger af behandlingen sammenlignet med nogle andre antipsykotiske lægemidler, der ikke kræver en lignende titrering. Forskrifterne skal være opmærksomme på denne forsinkelse, når de vælger et antipsykotisk lægemiddel til behandling af skizofreni.
fortsæt historien nedenfor
Dosering og administration
Almindelig dosering
FANAPT skal titreres langsomt fra en lav startdosis for at undgå ortostatisk hypotension på grund af dets alfa-adrenerge blokerende egenskaber. Den anbefalede startdosis til FANAPT tabletter er 1 mg oralt to gange dagligt. Dosisstigninger for at nå målet mellem 6 og 12 mg to gange dagligt (12_24 mg / dag) kan foretages med daglige dosisjusteringer for ikke at overstige 2 mg to gange dagligt (4 mg / dag). Den maksimale anbefalede dosis er 12 mg to gange dagligt (24 mg / dag). FANAPT-doser over 24 mg / dag er ikke systematisk vurderet i de kliniske forsøg. Effektivitet blev påvist med FANAPT i et dosisområde fra 6 til 12 mg to gange dagligt. Forskrifterne skal være opmærksomme på det faktum, at patienter skal titreres til en effektiv dosis FANAPT. Således kan kontrol med symptomer blive forsinket i løbet af de første 1 til 2 uger af behandlingen sammenlignet med nogle andre antipsykotiske lægemidler, der ikke kræver lignende titrering. Forskrifterne skal også være opmærksomme på, at nogle bivirkninger, der er forbundet med FANAPT-brug, er dosisrelaterede. FANAPT kan administreres uden hensyntagen til måltider.
Dosering i særlige befolkninger
Dosisjustering til patienter, der tager FANAPT samtidig med potentielle CYP2D6-hæmmere: FANAPT-dosis skal reduceret med halvdelen, når det administreres samtidig med stærke CYP2D6-hæmmere, såsom fluoxetin eller paroxetin. Når CYP2D6-hæmmeren trækkes ud af kombinationsbehandlingen, skal FANAPT-dosis derefter øges, til den var før.
Dosisjustering til patienter, der tager FANAPT samtidig med potentielle CYP3A4-hæmmere: FANAPT-dosis skal reduceret med halvdelen, når det administreres samtidig med stærke CYP3A4-hæmmere, såsom ketoconazol eller clarithromycin. Når CYP3A4-hæmmeren trækkes ud af kombinationsbehandlingen, skal FANAPT-dosis øges til det, hvor det var før.
Dosisjustering til patienter, der tager FANAPT, som er dårlige metaboliserende midler af CYP2D6: FANAPT-dosis skal reduceres med halvdelen for dårlige metabolisatorer af CYP2D6.
Nedsat leverfunktion: Dosisjustering af FANAPT er ikke nødvendig hos patienter med let nedsat leverfunktion. Patienter med moderat nedsat leverfunktion kan muligvis kræve dosisreduktion, hvis klinisk indikeret. FANAPT anbefales ikke til patienter med svær leverinsufficiens.
Vedligeholdelsesbehandling
I et længerevarende studie var FANAPT effektiv til at forsinke tid til tilbagefald hos patienter med skizofreni, som var stabiliseret på FANAPT op til 24 mg / dag. Patienter bør regelmæssigt revurderes for at bestemme behovet for vedligeholdelsesbehandling.
Genopbygning af behandlingen hos patienter, der tidligere blev afbrudt, selvom der ikke findes data til specifikt at adressere genoptagelse af behandling, anbefales det, at starttitreringsplanen følges, hver gang patienter har haft et interval fra FANAPT på mere end 3 dage.
top
Doseringsformer og styrker
FANAPT tabletter fås i følgende styrker: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg og 12 mg. Tabletterne er hvide, runde, flade, skrå kantede og identificeret med et logo “” præget på den ene side og tabletstyrken “1”, “2”, “4”, “6”, “8”, “10”, eller “12” preget på den anden side.
top
Kontraindikationer
FANAPT er kontraindiceret til personer med en kendt overfølsomhedsreaktion på produktet. Anafylaksi, angioødem og andre overfølsomhedsreaktioner er rapporteret.
top
ADVARSLER OG FORHOLDSREGLER
Øget dødelighed hos ældre patienter med demensrelateret psykose
Antipsykotiske stoffer øger dødsrisikoen hos ældre patienter med demensrelateret psykose. Analyser af 17 demensrelaterede, placebokontrollerede psykoseforsøg (modal varighed på 10 uger og stort set hos patienter, der tager atypiske antipsykotiske lægemidler) afslørede en risiko for død hos de lægemiddelbehandlede patienter på mellem 1,6 til 1,7 gange den hos placebo-behandlede patienter. I løbet af et typisk 10-ugers kontrolleret forsøg var dødsfrekvensen hos lægemiddelbehandlede patienter ca. 4,5% sammenlignet med en sats på ca. 2,6% hos placebo-behandlede patienter.
Selvom dødsårsagerne var forskellige, syntes de fleste dødsfald enten at være kardiovaskulære (f.eks. Hjertesvigt, pludselig død) eller infektiøs (f.eks. Lungebetændelse) i naturen. FANAPT er ikke godkendt til behandling af patienter med demensrelateret psykose.
Cerebrovaskulære bivirkninger, inklusive slagtilfælde, hos ældre patienter med demensrelateret psykose
I placebokontrollerede forsøg hos ældre med demens blev randomiserede patienter til risperidon, aripiprazol og olanzapin havde en højere forekomst af slagtilfælde og kortvarigt iskæmisk angreb, inklusive dødelig slag. FANAPT er ikke godkendt til behandling af patienter med demensrelateret psykose.
QT-forlængelse
I et åbent QTc-studie hos patienter med skizofreni eller skizoaffektiv lidelse (n = 160) blev FANAPT forbundet med en QTc-forlængelse på 9 msek ved en iloperidondosis på 12 mg to gange dagligt. Virkningen af FANAPT på QT-intervallet blev forstærket af tilstedeværelsen af CYP450 2D6 eller 3A4 metabolisk hæmning (henholdsvis paroxetin 20 mg en gang dagligt og ketoconazol 200 mg to gange dagligt). Under betingelser med metabolisk inhibering for både 2D6 og 3A4 var FANAPT 12 mg to gange dagligt forbundet med en gennemsnitlig QTcF-stigning fra basislinien på ca. 19 msek.
Der blev ikke observeret tilfælde af torsade de pointes eller andre alvorlige hjertearytmier under det kliniske program før markedsføring.
Brug af FANAPT bør undgås i kombination med andre lægemidler, der vides at forlænge QTc inklusive klasse 1A (f.eks. Quinidin, procainamid) eller klasse III (f.eks. amiodaron, sotalol) antiarytmiske medikamenter, antipsykotiske medikamenter (f.eks. chlorpromazin, thioridazin), antibiotika (f.eks. gatifloxacin, moxifloxacin) eller en hvilken som helst anden klasse af medikamenter, der vides at forlænge QTc-intervallet (f.eks. pentamidin, levomethadylacetat, metadon). FANAPT bør også undgås hos patienter med medfødt langt QT-syndrom og hos patienter med en historie med hjertearytmier.
Visse omstændigheder kan øge risikoen for torsade de pointes og / eller pludselig død i forbindelse med brug af medikamenter, der forlænger QTc-intervallet, herunder (1) bradykardi; (2) hypokalæmi eller hypomagnesæmi; (3) samtidig brug af andre lægemidler, der forlænger QTc-intervallet; og (4) tilstedeværelse af medfødt forlængelse af QT-intervallet; (5) nylig akut myokardieinfarkt; og / eller (6) ukompenseret hjertesvigt.
Forsigtighed er berettiget, når FANAPT ordineres med lægemidler, der hæmmer FANAPT-stofskifte, og hos patienter med nedsat aktivitet af CYP2D6.
Det anbefales, at patienter, der overvejes til FANAPT-behandling, er i risiko for betydelig elektrolytforstyrrelser har baseline-serumkalium- og magnesiummålinger med periodiske overvågning. Hypokalæmi (og / eller hypomagnesæmi) kan øge risikoen for forlængelse af QT og arytmi. FANAPT bør undgås hos patienter med historier om betydelig hjerte-kar-sygdom, fx QT forlængelse, nylig akut myokardieinfarkt, ukompenseret hjertesvigt eller hjertearytmi. FANAPT bør seponeres hos patienter, der viser sig at have vedvarende QTc-målinger> 500 msek.
Hvis patienter, der tager FANAPT, oplever symptomer, der kan indikere forekomsten af hjertearytmier, f.eks. svimmelhed, hjertebank eller synkope, bør forskriveren iværksætte yderligere evaluering, inklusive hjertestarter overvågning.
Neuroleptisk malignt syndrom (NMS)
Et potentielt dødeligt symptomkompleks, som nogle gange kaldes neuroleptisk malignt syndrom (NMS), er rapporteret i forbindelse med administration af antipsykotiske lægemidler, herunder FANAPT. Kliniske manifestationer inkluderer hyperpyrexia, muskelstivhed, ændret mental status (inklusive katatoniske tegn) og bevis for autonom ustabilitet (uregelmæssig puls eller blodtryk, takykardi, diaphorese og hjerte dysrytmi). Yderligere tegn kan omfatte forhøjet kreatinphosphokinase, myoglobinuria (rabdomyolyse) og akut nyresvigt. Den diagnostiske evaluering af patienter med dette syndrom er kompliceret. Når man ankommer til en diagnose, er det vigtigt at identificere tilfælde, hvor den kliniske præsentation inkluderer både alvorlig medicinsk sygdom og ubehandlet eller utilstrækkeligt behandlet ekstrapyramidale tegn og symptomer (EPS). Andre vigtige overvejelser ved den differentierede diagnose inkluderer central antikolinerg toksicitet, heteslag, lægemiddelfeber og primær centralnervesystem (CNS) patologi.
Håndteringen af dette syndrom bør omfatte: (1) øjeblikkelig seponering af de antipsykotiske lægemidler og andre lægemidler, der ikke er nødvendige for samtidig behandling, (2) intensiv symptomatisk behandling og medicinsk overvågning og (3) behandling af alle ledsagende alvorlige medicinske problemer, som specifikke behandlinger er tilgængelige for. Der er ingen generel aftale om specifikke farmakologiske behandlingsregimer for NMS.
Hvis en patient har behov for antipsykotisk lægemiddelbehandling efter genopretning efter NMS, skal den potentielle genindførelse af lægemiddelterapi overvejes nøje. Patienten skal overvåges omhyggeligt, da der er rapporteret om gentagelser af NMS.
Tardive Dyskinesia
Tardiv dyskinesi er et syndrom, der består af potentielt irreversible, ufrivillige, dyskinetiske bevægelser, som kan udvikle sig hos patienter, der behandles med antipsykotiske stoffer. Selvom forekomsten af syndromet ser ud til at være størst blandt ældre, især ældre kvinder, er det umuligt at gøre det stole på prævalensestimater for at forudsige ved begyndelsen af antipsykotisk behandling, hvilke patienter der sandsynligvis vil udvikle syndrom. Hvorvidt antipsykotiske lægemidler adskiller sig i deres potentiale til at forårsage tardiv dyskinesi er ukendt.
Risikoen for at udvikle tardiv dyskinesi og sandsynligheden for, at den bliver irreversibel, antages for at øges som behandlingsvarighed og den samlede kumulative dosis af antipsykotisk indgivet stiger. Syndromet kan imidlertid udvikle sig, skønt meget mindre almindeligt, efter relativt korte behandlingsperioder i lave doser.
Der er ingen kendt behandling for etablerede tilfælde af tardiv dyskinesi, skønt syndromet måske går delvist eller fuldstændigt tilbage, hvis antipsykotisk behandling trækkes tilbage. Selve antipsykotisk behandling kan imidlertid undertrykke (eller delvist undertrykke) symptomerne på syndromet og derved muligvis maske den underliggende proces. Effekten, som symptomatisk undertrykkelse har på det langsigtede forløb af syndromet, er ukendt.
I betragtning af disse overvejelser skal FANAPT ordineres på en måde, der mest sandsynligt minimerer forekomsten af tardiv dyskinesi. Kronisk antipsykotisk behandling bør generelt reserveres til patienter, der lider af en kronisk sygdom, som (1) vides at reagere på antipsykotiske lægemidler, og (2) for hvilke der ikke findes alternative, lige så effektive, men potentielt mindre skadelige behandlinger eller passende. Hos patienter, der kræver kronisk behandling, skal den mindste dosis og den korteste behandlingsvarighed, der producerer en tilfredsstillende klinisk respons, søges. Behovet for fortsat behandling bør revurderes med jævne mellemrum.
Hvis der forekommer tegn og symptomer på tardiv dyskinesi hos en patient på FANAPT, bør lægemidlets ophør overvejes. Nogle patienter kan dog kræve behandling med FANAPT på trods af tilstedeværelsen af syndromet.
Metabolske ændringer
Atypiske antipsykotiske lægemidler er blevet forbundet med metaboliske ændringer, der kan øge den kardiovaskulære / cerebrovaskulære risiko. Disse metaboliske ændringer inkluderer hyperglykæmi, dyslipidæmi og kropsvægtøgning. Selvom det er vist, at alle atypiske antipsykotiske medikamenter producerer nogle metaboliske ændringer, har hvert lægemiddel i klassen sin egen specifikke risikoprofil.
Hyperglykæmi og Diabetes Mellitus
Hyperglykæmi, i nogle tilfælde ekstrem og forbundet med ketoacidose eller hyperosmolær koma eller død, er rapporteret hos patienter, der er behandlet med atypiske antipsykotika, herunder FANAPT. Vurdering af forholdet mellem atypisk antipsykotisk brug og glukose abnormaliteter kompliceres af muligheden for en forøget baggrundsrisiko for diabetes mellitus hos patienter med skizofreni og den stigende forekomst af diabetes mellitus generelt befolkning. I betragtning af disse konfunderere er forholdet mellem atypisk antipsykotisk brug og hyperglykæmi-relaterede bivirkninger ikke helt forstået. Epidemiologiske undersøgelser antyder imidlertid en øget risiko for hyperglykæmirelaterede bivirkninger hos patienter, der blev behandlet med de atypiske antipsykotika, der er inkluderet i disse undersøgelser.
Patienter med en fastlagt diagnose af diabetes mellitus, der er startet på atypiske antipsykotika, skal overvåges regelmæssigt for forværring af glukosekontrol. Patienter med risikofaktorer for diabetes mellitus (f.eks. Overvægt, familiehistorie med diabetes), som begynder behandling med atypiske antipsykotika skal gennemgå fastende blodsukkertest i begyndelsen af behandlingen og med jævne mellemrum behandling. Enhver patient, der behandles med atypiske antipsykotika, skal overvåges for symptomer på hyperglykæmi, herunder polydipsi, polyuri, polyfagi og svaghed. Patienter, der udvikler symptomer på hyperglykæmi under behandling med atypiske antipsykotika, skal gennemgå fastende blodsukkertest. I nogle tilfælde er hyperglykæmi forsvundet, da den atypiske antipsykotika blev afbrudt; nogle patienter krævede imidlertid fortsættelse af antidiabetisk behandling på trods af seponering af det mistænkte lægemiddel.
Data fra et 4-ugers fast dosisundersøgelse hos voksne personer med skizofreni, hvori der blev taget fastende blodprøver, er vist i tabel 1.
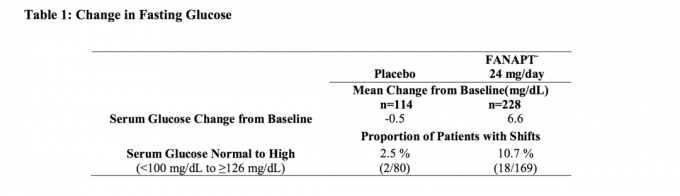
Samlede analyser af glukosedata fra kliniske studier, inklusive langtidsforsøg, er vist i tabel2.
dyslipidæmi
Uønskede ændringer i lipider er observeret hos patienter behandlet med atypiske antipsykotika.
Data fra et placebokontrolleret, 4 ugers fast dosis stud, hvor faste blodprøver blev taget, hos voksne personer med skizofreni er vist i tabel 3.

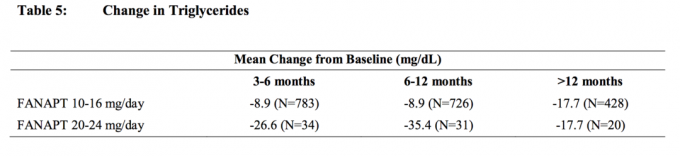
Samlede analyser af kolesterol- og triglyceriddata fra kliniske studier, inklusive længerevarende forsøg, er vist i tabel 4 og tabel 5.

Vægtøgning
Der er observeret vægtøgning ved atypisk antipsykotisk anvendelse. Klinisk monitorering af vægt anbefales.
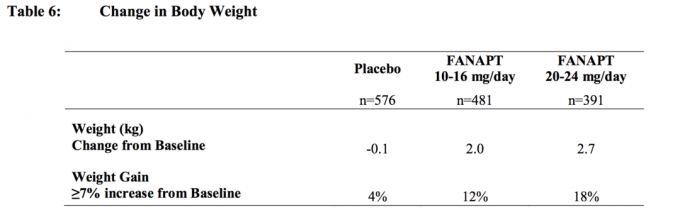
I alle kort- og langtidsundersøgelser var den samlede gennemsnitlige ændring fra basislinien ved slutpunkt 2,1 kg.
Ændringer i kropsvægt (kg) og andelen af personer med ≥7% stigning i kropsvægt fra 4 placebo-kontrollerede, 4- eller 6-ugers, faste eller fleksible dosisundersøgelser hos voksne individer præsenteres i Tabel 6
kramper
I kortvarige placebokontrollerede forsøg (4- til 6 uger) forekom anfald hos 0,1% (1/1344) af patienter behandlet med FANAPT sammenlignet med 0,3% (2/587) på placebo. Som med andre antipsykotika bør FANAPT bruges med forsigtighed til patienter med en anamnese med anfald eller med tilstande, der potentielt kan sænke for anfaldstærsklen. Forhold, der sænker anfaldstærsklen, kan være mere udbredt i en befolkning på 65 år eller ældre.
Ortostatisk hypotension og synkope
FANAPT kan inducere ortostatisk hypotension forbundet med svimmelhed, tachycardia og synkope. Dette afspejler dets alfa-adrenerge antagonistegenskaber. I dobbeltblinde placebokontrollerede kortvarige studier, hvor dosis blev øget langsomt som anbefalet ovenfor blev synkope rapporteret hos 0,4% (5/1344) af patienter behandlet med FANAPT sammenlignet med 0,2% (1/587) på placebo. Ortostatisk hypotension blev rapporteret hos 5% af patienterne, der fik 20-24 mg / dag, 3% af patienterne fik 10-16 mg / dag og 1% af patienterne fik placebo. En hurtigere titrering forventes at øge frekvensen af ortostatisk hypotension og synkope.
FANAPT skal anvendes med forsigtighed til patienter med kendt hjerte-kar-sygdom (f.eks. Hjertesvigt, historie med hjerteinfarkt, iskæmi eller ledning abnormaliteter), cerebrovaskulær sygdom eller tilstande, der disponerer patienten for hypotension (dehydrering, hypovolæmi og behandling med antihypertensiv medicin). Overvågning af ortostatiske vitale tegn bør overvejes hos patienter, der er sårbare over for hypotension.
Leukopeni, Neutropenia og Agranulocytosis
I klinisk forsøg og efter markedsføring er rapporteret om hændelser med leukopeni / neutropeni midlertidigt relateret til antipsykotiske midler. Agranulocytose (inklusive dødelige tilfælde) er også rapporteret.
Mulige risikofaktorer for leukopeni / neutropeni inkluderer forudgående eksisterende antal hvide blodlegemer (WBC) og historien om lægemiddelinduceret leukopeni / neutropeni. Patienter med en eksisterende lav WBC eller en historie med medikamentinduceret leukopeni / neutropeni bør have deres fulde blodantal (CBC) overvåget ofte i de første par behandlingsmåneder og bør afbryde FANAPT ved det første tegn på et fald i WBC i fravær af anden årsag faktorer.
Patienter med neutropeni skal overvåges nøje for feber eller andre symptomer eller tegn på infektion og behandles omgående, hvis sådanne symptomer eller tegn opstår. Patienter med svær neutropeni (absolut neutrofiltal <1000 / mm3) skal afbryde FANAPT og få deres WBC fulgt indtil bedring.
hyperprolaktinemi
Som med andre lægemidler, der modvirker dopamin D2-receptorer, hæver FANAPT prolactinniveauer.
Hyperprolactinemia kan undertrykke hypothalamisk GnRH, hvilket resulterer i reduceret hypofysegonadotropinsekretion. Dette kan igen hæmme reproduktiv funktion ved at nedsætte gonadalsteroidogenese hos både kvindelige og mandlige patienter. Galactorrhea, amenorrhea, gynecomastia og impotens er blevet rapporteret med prolactin-forhøjende forbindelser. Langvarig hyperprolactinæmi, når det er forbundet med hypogonadisme, kan føre til nedsat knogletæthed hos både kvindelige og mandlige patienter.
Vævskultureksperimenter indikerer, at cirka en tredjedel af humane brystkræft er prolaktinafhængig in vitro, en faktor af potentiel betydning, hvis recept af disse lægemidler overvejes hos en patient med tidligere påvist bryst Kræft. Proliferative ændringer i brystkirtlen og stigninger i serumprolactin blev set hos mus og rotter behandlet med FANAPT. Hverken kliniske studier eller epidemiologiske undersøgelser, der er foretaget til dato, har vist en sammenhæng mellem kronisk indgivelse af denne klasse af lægemidler og tumorigenese hos mennesker; den tilgængelige dokumentation betragtes som for begrænset til at være afgørende på dette tidspunkt.
I et kortvarigt placebokontrolleret forsøg (4 uger) var den gennemsnitlige ændring fra basislinje til slutpunkt i plasmaprolactinniveauer for FANAPT 24 mg / dag-behandlet gruppe var en stigning på 2,6 ng / ml sammenlignet med et fald på 6,3 ng / ml i placebo-gruppen. I dette forsøg blev forhøjede plasmaprolactinniveauer observeret hos 26% af voksne behandlet med FANAPT sammenlignet med 12% i placebogruppen. I de kortvarige forsøg var FANAPT forbundet med beskedne niveauer af prolactinforøgelse sammenlignet med større prolaktinforhøjelser observeret med nogle andre antipsykotiske midler. I samlet analyse fra kliniske studier, inklusive længerevarende forsøg, blev der i 3210 voksne behandlet med iloperidon rapporteret gynecomastia hos 2 mandlige forsøgspersoner (0,1%) sammenlignet med 0% hos placebo-behandlede patienter, og galactorrhea blev rapporteret hos 8 kvindelige individer (0,2%) sammenlignet med 3 kvindelige individer (0,5%) hos placebo-behandlede patienter.
Regulering af kropstemperatur
Forstyrrelse af kroppens evne til at reducere kernekropstemperaturen er blevet tilskrevet antipsykotiske midler. Passende pleje tilrådes, når FANAPT ordineres til patienter, der vil opleve tilstande, som kan bidrage til en forhøjelse af kropskroppen temperatur, fx træning hårdt, eksponering for ekstrem varme, modtagelse af samtidig medicinering med antikolinerg aktivitet eller at være underlagt dehydrering.
Dysfagi
Esophageal dysmotilitet og aspiration er blevet forbundet med antipsykotisk stofbrug. Aspiration lungebetændelse er en almindelig årsag til sygelighed og dødelighed hos ældre patienter. FANAPT og andre antipsykotiske lægemidler skal bruges med forsigtighed til patienter, der er i risiko for aspiration lungebetændelse.
Selvmord
Muligheden for et selvmordsforsøg er iboende i psykotisk sygdom, og nøje tilsyn med højrisikopatienter bør ledsage lægemiddelterapi. Recepter til FANAPT skal skrives for den mindste mængde tabletter, der er i overensstemmelse med god patienthåndtering for at reducere risikoen for overdosering.
priapisme
Tre tilfælde af priapisme blev rapporteret i FANAPT-programmet før markedsføring. Der er rapporteret, at lægemidler med alfa-adrenerge blokerende virkninger inducerer priapisme. FANAPT deler denne farmakologiske aktivitet. Alvorlig priapisme kan kræve kirurgisk indgreb.
Potentiale for kognitiv og motorisk handicap
FANAPT har som andre antipsykotika potentialet til at forringe dømmekraft, tænkning eller motoriske færdigheder. I kortvarige, placebokontrollerede forsøg blev der rapporteret somnolens (inklusive sedation) i 11,9% (104/874) af voksne patienter behandlet med FANAPT i doser på 10 mg / dag eller mere mod 5,3% (31/587) behandlet med placebo. Patienter skal advares om betjening af farlige maskiner, inklusive biler, indtil de med rimelighed er sikre på, at behandling med FANAPT ikke påvirker dem negativt.
top
Bivirkninger
Erfaring med kliniske studier
Da kliniske forsøg udføres under vidt forskellige betingelser, observeres bivirkningsrater i det kliniske forsøg med et lægemiddel kan ikke sammenlignes direkte med satser i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de observerede satser i klinisk øve sig. Oplysningerne nedenfor stammer fra en klinisk forsøgsdatabase for FANAPT bestående af 3229 patienter udsat for FANAPT i doser på 10 mg / dag eller derover til behandling af skizofreni. Af disse modtog 999 FANAPT i mindst 6 måneder, hvor 657 blev udsat for FANAPT i mindst 12 måneder. Alle disse patienter, der modtog FANAPT, deltog i kliniske forsøg med multiple doser. Betingelserne og varigheden af behandlingen med FANAPT varierede meget og inkluderede (i overlappende kategorier), open-label og dobbeltblinde faser af undersøgelser, ambulante og ambulante patienter, faste doser og fleksible doser og kortvarige og længerevarende udsættelse.
Oplysningerne præsenteret i disse sektioner stammer fra samlede data fra 4 placebo-kontrollerede, 4- eller 6-uger, faste eller fleksible dosisundersøgelser hos patienter, der modtog FANAPT i daglige doser inden for et område fra 10 til 24 mg (N = 874).
Bivirkninger, der forekommer med en forekomst på 2% eller mere blandt FANAPT-behandlede patienter og hyppigere end placebo
Tabel 7 viser de samlede forekomster af bivirkninger, der spontant blev rapporteret i fire placebokontrollerede, 4- eller 6-uger, faste eller fleksible dosisundersøgelser, der viser de reaktioner, der opstod hos 2% eller mere af patienter behandlet med FANAPT i en hvilken som helst af dosis grupper, og for hvilke incidensen hos FANAPT-behandlede patienter i en hvilken som helst dosisgruppe var større end forekomsten hos patienter behandlet med placebo.
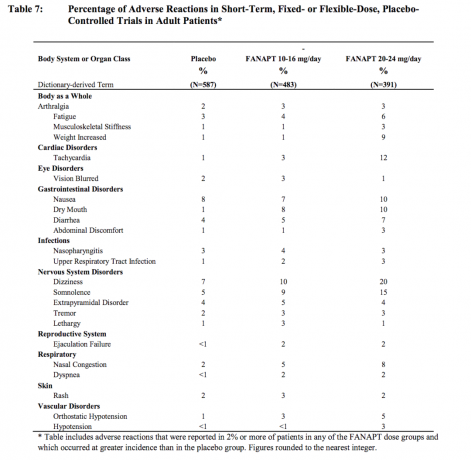
Dosisrelaterede bivirkninger i kliniske forsøg
Baseret på de samlede data fra 4 placebokontrollerede, 4- eller 6-ugers studier med fast eller fleksibel dosis, var bivirkninger, der opstod med mere end 2% forekomst hos patienter behandlet med FANAPT, og for hvilken incidensen hos patienter behandlet med FANAPT 20-24 mg / dag var dobbelt end forekomsten i patienter behandlet med FANAPT 10-16 mg / dag var: abdominal ubehag, svimmelhed, hypotension, stivhed i bevægeapparatet, takykardi og vægt steget.
Almindelige og lægemiddelrelaterede bivirkninger i kliniske forsøg
Baseret på de samlede data fra 4 placebokontrollerede, 4- eller 6-ugers, faste eller fleksible dosisundersøgelser, forekom de følgende bivirkninger i ≥5% forekomst hos de behandlede patienter med FANAPT og mindst to gange placebo rotten i mindst 1 dosis: svimmelhed, tør mund, træthed, næsehæmning, somnolens, takykardi, ortostatisk hypotension og vægt steget. Svimmelhed, takykardi og stigning i vægten var mindst dobbelt så almindelig på 20-24 mg / dag som på 10-16 mg / dag.
Ekstrapyramidale symptomer (EPS) i kliniske forsøg
Samlede data fra de 4 placebokontrollerede, 4- eller 6- uges studier med fast eller fleksibel dosis gav information om EPS. Data om bivirkninger, der blev indsamlet fra disse forsøg, viste følgende satser af EPS-relaterede bivirkninger som vist i tabel 8.

Bivirkninger forbundet med seponering af behandling i kliniske forsøg
Baseret på de samlede data fra 4 placebokontrollerede, 4- eller 6-ugers, faste eller fleksible doserundersøgelser, var der ingen forskel i forekomsten af seponering på grund af bivirkninger mellem FANAPT-behandlet (5%) og placebo-behandlet (5%) patienter. Typerne af bivirkninger, der førte til seponering, var ens for de FANAPT- og placebo-behandlede patienter.
Demografiske forskelle i bivirkninger i kliniske forsøg
En undersøgelse af befolkningsundergrupper i de 4 placebokontrollerede, 4- eller 6-ugers, faste- eller studier med fleksibel dosis afslørede ikke noget bevis for forskelle i sikkerhed på grundlag af alder, køn eller race.
Laboratorieundersøgelser i kliniske forsøg
Der var ingen forskelle mellem FANAPT og placebo i forekomsten af seponering på grund af ændringer i hæmatologi, urinalyse eller serumkemi.
I kortvarige placebokontrollerede forsøg (4- til 6 uger) var der 1,0% (13/1342) iloperidon-behandlede patienter med hæmatokrit mindst en gang under det udvidede normale interval under post-randomiseringsbehandling sammenlignet med 0,3% (2/585) på placebo. Det udvidede normale interval for sænket hæmatokrit blev defineret i hver af disse forsøg som værdien 15% under det normale interval for det centraliserede laboratorium, der blev anvendt i forsøget.
Andre reaktioner i løbet af den før-markedsføringsevaluering af FANAPT
Det følgende er en liste over MedDRA-termer, der afspejler bivirkninger hos patienter behandlet med FANAPT ved flere doser ≥ 4 mg / dag i enhver fase af et forsøg med databasen til 3210 FANAPT-behandlet patienter. Alle rapporterede reaktioner er inkluderet undtagen dem, der allerede er anført i tabel 7, eller andre dele af bivirkningerne (6), dem, der er betragtet i Advarsler og forsigtighedsregler (5), de reaktionsbetingelser, der var så generelle, at de var uinformative, reaktioner rapporteret hos færre end 3 patienter, og som var hverken alvorlige eller livstruende, reaktioner, der ellers er almindelige som baggrundsreaktioner, og reaktioner, der betragtes som usandsynlige at være stof relaterede.
Reaktioner er yderligere kategoriseret efter MedDRA-systemorganklasse og anført i rækkefølge efter faldende frekvens i henhold til følgende definitioner: hyppige bivirkninger er dem, der forekommer hos mindst 1/100 patienter (kun de, der ikke er anført i tabel 7, vises i dette notering); sjældne bivirkninger er dem, der forekommer hos 1/100 til 1/1000 patienter; sjældne hændelser er dem, der forekommer hos færre end 1/1000 patienter.
Blod- og lymfatiske forstyrrelser: Hyppigt - anæmi, jernmangelanæmi; Sjældne leukopeni
Hjertesygdomme: Hyppige - hjertebank; Sjælden - arytmi, atrioventrikulær blok første grad, hjertesvigt (inklusive kongestiv og akut)
Øre- og labyrintforstyrrelser: sjældent – svimmelhed, tinnitus
Endokrine lidelser: Hyppigt - hypothyreoidisme
Øjenlidelser: Hyppig - konjunktivitis (inklusive allergisk); Sjældent - tørt øje, blepharitis, øjenlågødem, hævelse i øjnene, linsefarvende opaciteter, grå stær, hyperæmi (inklusive konjunktival)
Gastrointestinale forstyrrelser: sjældent - gastritis, spyt hypersekretion, fækal inkontinens, mavesår; Sjælden - afthous stomatitis, duodenal ulcer, hiatus hernia, hyperchlorhydria, lip ulceration, reflux esophagitis, stomatitis
Generelle forstyrrelser og administrationssituationer: Sjældent - ødemer (generelt, pitting, på grund af hjertesygdom), vanskeligheder ved at gå, tørst; Sjælden - hypertermi
Nedsat leverfunktion: Sjældent - cholelithiasis
Undersøgelser: Hyppig: vægten faldt; Sjældent - hæmoglobin faldt, antallet af neutrofiler steg, hæmatokrit faldt
Metabolisme og ernæringsforstyrrelser: sjældent - øget appetit, dehydrering, hypokalæmi, væskeretention
Muskuloskeletale og bindevævssygdomme: Hyppige - myalgi, muskelspasmer; Sjælden - torticollis
Forstyrrelser i nervesystemet: Sjælden – paræstesi, psykomotorisk hyperaktivitet, rastløshed, hukommelsestap, nystagmus; Sjælden - rastløse bensyndrom
Psykiatriske forstyrrelser: Hyppig - rastløshed, aggression, vrangforestilling; Sjældent - fjendtlighed, nedsat libido, paranoia, anorgasmia, forvirringstilstand, mani, katatoni, humørsvingninger, panik angreb, obsessiv-kompulsiv lidelse, bulimia nervosa, delirium, polydipsi psykogen, impuls-kontrol lidelse, større depression
Nyre- og urinproblemer: Hyppig - urininkontinens; Sjældent - dysuri, pollakiuria, enurese, nefrolithiasis; Sjælden - urinretention, akut nyresvigt
Reproduktionssystem og brystforstyrrelser: Hyppig - erektil dysfunktion; Forekomst - testikelsmerter, amenoré, brystsmerter; Sjælden - menstruation uregelmæssig, gynecomastia, menorrhagia, metrorrhagia, postmenopausal blødning, prostatitis.
Åndedrætsorganer, Thoracic og Mediastinal forstyrrelser: Sjældent - epistaxis, astma, rhinorrhea, bihule i sinus, tørhed i næsen; Sjælden - tør hals, søvnapnø-syndrom, dyspné anstrengelse
Postmarketing-oplevelse
Følgende bivirkninger er blevet identificeret under brug af FANAPT efter godkendelse: retrograd ejakulation og overfølsomhedsreaktioner (inklusive anafylaksi; angioødem; tæthed i halsen; oropharyngeal hævelse; hævelse i ansigt, læber, mund og tunge; urticaria; udslæt; og kløe). Da disse reaktioner frivilligt blev rapporteret fra en population af usikker størrelse, er det ikke muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng med lægemiddeleksponering.
top
Lægemiddelinteraktioner
I betragtning af de primære CNS-virkninger af FANAPT, skal der udvises forsigtighed, når det tages i kombination med andre centralt virkende stoffer og alkohol. På grund af dens - alfa-adrenerge receptorantagonisme har FANAPT potentiale til at øge effekten af visse antihypertensive midler.
Potentiale for andre stoffer til at påvirke FANAPT
Iloperidon er ikke et substrat for CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 eller CYP2E1 enzymer. Dette antyder, at en interaktion mellem iloperidon og inhibitorer eller inducerere af disse enzymer eller andre faktorer som rygning er usandsynlig. Både CYP3A4 og CYP2D6 er ansvarlige for iloperidonmetabolismen. Inhibitorer af CYP3A4 (f.eks. Ketoconazol) eller CYP2D6 (f.eks. Fluoxetin, paroxetin) kan hæmme eliminering af iloperidon og forårsage forhøjede blodniveauer.
Ketoconazol: Samtidig administration af ketoconazol (200 mg to gange dagligt i 4 dage), en potent hæmmer af CYP3A4, med en 3 mg enkelt dosis iloperidon til 19 raske frivillige i alderen 18-45 år øgede området under kurven (AUC) af iloperidon og dets metabolitter P88 og P95 med 57%, 55% og 35%, henholdsvis. Iloperidondoser bør reduceres med ca. halvdelen, når de administreres sammen med ketoconazol eller andre stærke CYP3A4-hæmmere (f.eks. Itraconazol). Højere hæmmere (f.eks. Erythromycin, grapefrugtjuice) er ikke undersøgt. Når CYP3A4-hæmmeren trækkes ud af kombinationsbehandlingen, skal iloperidondosis returneres til det forrige niveau.
Fluoxetin: Samtidig administration af fluoxetin (20 mg to gange dagligt i 21 dage), en potent hæmmer af CYP2D6, med en enkelt 3 mg dosis iloperidon til 23 sunde frivillige, i alderen 29-44 år, der blev klassificeret som CYP2D6 omfattende metabolisatorer, øgede AUoper af iloperidon og dets metabolit P88 med ca. 2- til 3 gange, og formindskede AUC for dens metabolit P95 med en halv. Doserne af Iloperidon bør reduceres med halvdelen, når de administreres sammen med fluoxetin. Når fluoxetin fjernes fra kombinationsbehandlingen, skal iloperidondosis returneres til det forrige niveau. Andre stærke hæmmere af CYP2D6 forventes at have lignende effekter og ville have behov for passende dosisreduktion. Når CYP2D6-hæmmeren trækkes ud af kombinationsbehandlingen, kan iloperidondosis derefter øges til det forrige niveau.
Paroxetin: Samtidig administration af paroxetin (20 mg / dag i 5-8 dage), en potent hæmmer af CYP2D6, med flere doser af iloperidon (8 eller 12 mg to gange dagligt) til patienter med skizofreni i alderen 18-65 år resulterede i øgede gennemsnitlige stabilitetstopkoncentrationer på iloperidon og dets metabolit P88, ca. 1,6 gange, og faldt gennemsnitlige stabile topponcentrationer af dens metabolit P95 med en halv. Iloperidondoser bør reduceres med halvdelen, når de administreres sammen med paroxetin. Når paroxetin fjernes fra kombinationsbehandlingen, skal iloperidondosis returneres til det forrige niveau. Andre stærke hæmmere af CYP2D6 forventes at have lignende effekter og ville have behov for passende dosisreduktion. Når CYP2D6-hæmmeren trækkes ud af kombinationsterapien, kan iloperidondosis derefter øges til tidligere niveauer.
Paroxetin og Ketoconazol: Samtidig administration af paroxetin (20 mg en gang dagligt i 10 dage), en CYP2D6-hæmmer og ketoconazol (200 mg) to gange dagligt) med flere doser iloperidon (8 eller 12 mg to gange dagligt) til patienter med skizofreni i alderen 18-65 år resulterede i en 1,4 fold stigning i steady-state-koncentrationer af iloperidon og dets metabolit P88 og et 1,4 gange fald i P95 i nærvær af paroxetin. Så at give iloperidon med hæmmere af begge dets metabolske veje føjede ikke til virkningen af en af inhibitorerne, der blev givet alene. Iloperidondoser bør derfor reduceres med ca. halvdelen, hvis de administreres samtidig med både en CYP2D6 og CYP3A4-hæmmer.
Potentiale for FANAPT til at påvirke andre stoffer
In vitro-undersøgelser i humane levermikrosomer viste, at iloperidon ikke i væsentlig grad hæmmer metabolismen af lægemidler, der metaboliseres af følgende cytochrome P450-isozymer: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 eller CYP2E1. Endvidere viste in vitro-undersøgelser i humane levermikrosomer, at iloperidon ikke har enzyminducerende egenskaber, specifikt til følgende cytochrome P450-isozymer: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 og CYP3A5.
Dextromethorphan: En undersøgelse med raske frivillige viste, at ændringer i farmakokinetikken af dextromethorphan (80 mg dosis), når en 3 mg dosis på iloperidon blev administreret samtidig resulterede i en 17% stigning i den samlede eksponering og en 26% stigning i de maksimale plasmakoncentrationer Cmax på dextromethorphan. Således er en interaktion mellem iloperidon og andre CYP2D6-underlag usandsynlig.
Fluoxetin: En enkelt 3 mg dosis iloperidon havde ingen effekt på farmakokinetikken for fluoxetin (20 mg to gange dagligt).
Midazolam (et følsomt CYP 3A4-underlag): En undersøgelse hos patienter med skizofreni viste en stigning på mindre end 50% i midazolam i alt eksponering ved iloperidon-konstant tilstand (14 dages oral dosering med op til 10 mg iloperidon to gange dagligt) og ingen effekt på midazolam C max. Således er en interaktion mellem iloperidon og andre CYP3A4-underlag usandsynlig.
Lægemidler, der forlænger QT-intervallet FANAPT, bør ikke bruges sammen med andre lægemidler, der forlænger QT-intervallet.
top
Brug i specifikke befolkninger
Registreringsregister for graviditet
Der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der udsættes for FANAPT under graviditet. For mere information kontakt National Graviditetsregisteret for atypiske antipsykotika på 1-866-961-2388 eller besøg http://womensmentalhealth.org/clinical-and -Forskning-programmer / pregnancyregistry /.
Risikosammendrag
Nyfødte, hvis mødre udsættes for antipsykotiske lægemidler, inklusive FANAPT, i tredje trimester af graviditeten er i risiko for ekstrapyramidale og / eller abstinenssymptomer efter fødslen. De begrænsede tilgængelige data med FANAPT hos gravide er ikke tilstrækkelige til at informere medikamentassocieret risiko for større fødselsdefekter og spontanabort. Iloperidon var ikke teratogent, når det blev indgivet oralt til gravide rotter under organogenese i doser op til 26 gange den maksimale anbefalede humane dosis på 24 mg / dag på mg / m2-basis. Imidlertid forlængede det varigheden af graviditet og fødslen, øgede stillfødsler, tidlige intrauterine dødsfald, øget forekomst af udviklingsforsinkelser og nedsat overlevelse efter valpen. Iloperidon var ikke teratogent, når det blev indgivet oralt til gravide kaniner under organogenese i doser op til 20 gange s MRHD på mg / m2-basis. Imidlertid øgede det tidlige intrauterine dødsfald og nedsatte føtalt levedygtighed på sigt ved den højeste dosis, som også var en maternelt toksisk dosis.
Baggrundsrisikoen for større fødselsdefekter og spontanabort for den angivne population er ukendt. I den amerikanske generelle befolkning er den estimerede baggrundsrisiko for større fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2-4% og 15-20%.
Kliniske overvejelser
Foster / neonatal bivirkninger
Ekstrapyramidale og / eller abstinenssymptomer, herunder agitation, hypertoni, hypotoni, tremor, somnolens, respirerende nød og der er rapporteret om fødeforstyrrelse hos nyfødte, hvis mødre blev udsat for antipsykotiske stoffer i tredje trimester af graviditet. Disse symptomer har varieret i sværhedsgrad. Nogle nyfødte blev frisk efter timer eller dage uden specifik behandling; andre krævede langvarig indlæggelse. Overvåg nyfødte for ekstrapyramidale og / eller abstinenssymptomer og håndter symptomer korrekt.
Data
Dyredata
I en embryo-fosterudviklingsundersøgelse blev gravide rotter givet 4, 16 eller 64 mg / kg / dag (1,6, 6,5 og 26 gange maksimal anbefalet human dosis (MRHD) på 24 mg / dag på mg / m2 basis) iloperidon oralt i perioden fra organdannelse. Den højeste dosis forårsagede øgede tidlige intrauterine dødsfald, nedsat føtal vægt og længde, nedsat fostret knoglesbenificering og en øget forekomst af mindre føtal skeletale anomalier og variationer; denne dosis forårsagede også et fald i fødevareforbruget og vægtøgning.
I en embryo-fosterudviklingsundersøgelse blev gravide kaniner givet 4, 10 eller 25 mg / kg / dag (3, 8 og 20 gange MRHD på mg / m2 basis) iloperidon i perioden med organogenese. Den højeste dosis forårsagede øgede tidlige intrauterine dødsfald og nedsat føtalt levedygtighed efter termin; denne dosis forårsagede også toksicitet hos moderen.
I yderligere undersøgelser, hvor rotter blev givet iloperidon i doser svarende til ovenstående, begyndte enten fra undfangelsen eller fra dag 17 i drægtighedsperioden og fortsat gennem fravænning, negative reproduktionseffekter inkluderede forlænget graviditet og fødsel, øget dødfødselsrater, øget forekomst af føtal viscerale variationer, nedsat føtale og hvalpevægt og faldet efter fødslen overlevelse. Der var ingen lægemiddelvirkninger på neurobevægelses- eller reproduktionsudviklingen hos de overlevende unger. Dosis uden virkning varierede fra 4 til 12 mg / kg bortset fra stigningen i dødfødningshastigheder, der forekom ved den laveste testede dosis på 4 mg / kg, hvilket er 1,6 gange MRHD på mg / m2-basis. Mødretoksicitet blev set ved de højere doser i disse undersøgelser.
Iloperidonmetabolitten P95, som er en vigtig cirkulationsmetabolit af iloperidon hos mennesker, men ikke er til stede i signifikante mængder i rotter blev givet til drægtige rotter i perioden med organogenese i orale doser på 20, 80 eller 200 mg kg / dag. Der blev ikke set teratogene effekter. Forsinket skeletdannelse optrådte ved alle doser. Der blev ikke produceret nogen signifikant maternel toksicitet. Plasmaniveauer af P95 (AUC) ved den højeste testede dosis var 2 gange niveauerne hos mennesker, der fik MRHD af iloperidon.
Amning
Risikosammendrag
Der findes ingen oplysninger om tilstedeværelsen af iloperidon eller dets metabolitter i modermælk, effekter af iloperidon på et ammet barn, heller ikke virkningen af iloperidon på modermælk produktion. Iloperidon er til stede i rottemælk. På grund af potentialet for alvorlige bivirkninger hos ammede spædbørn, råd en kvinde om ikke at amme under behandling med FANAPT.
Data Overførsel af radioaktivitet i mælken hos ammende rotter blev undersøgt efter en enkelt dosis [14C] iloperidon ved 5 mg / kg. Koncentrationen af radioaktivitet i mælk 4 timer efter dosis var næsten 10 gange større end i plasma på samme tid. Ved 24 timer efter dosering var koncentrationer af radioaktivitet i mælk imidlertid faldet til værdier lidt lavere end plasma. Den metabolske profil i mælk var kvalitativt ligner den i plasma.
Pædiatrisk brug Der er ikke påvist sikkerhed og effektivitet hos pædiatriske og unge patienter.
Geriatrisk brug
Kliniske studier af FANAPT til behandling af skizofreni inkluderede ikke tilstrækkeligt antal patienter på 65 år og derover for at afgøre, om de reagerer anderledes end yngre voksne patienter. Af de 3210 patienter, der blev behandlet med FANAPT i forudgående markedsføringsforsøg, var 25 (0,5%) ≥65 år gamle, og der var ingen patienter ≥75 år gamle.
Ældre patienter med demensrelateret psykose behandlet med FANAPT har en øget risiko for død sammenlignet med placebo. FANAPT er ikke godkendt til behandling af patienter med demensrelateret psykose.
Nedsat nyrefunktion
Da FANAPT er stærkt metaboliseret, med mindre end 1% af lægemidlet udskilt uændret, er det ikke sandsynligt, at nedsat nyrefunktion har en betydelig indflydelse på FANAPTs farmakokinetik. Nedsat nyrefunktion (kreatininclearance <30 ml / min) havde minimal effekt på Cmax af iloperidon (givet i en enkelt dosis på 3 mg) og dets metabolitter P88 og P95 i en hvilken som helst af de 3analytter, der blev målt. AUC0– ∞ steg med 24%, faldt med 6% og steg med 52% for henholdsvis iloperidon, P88 og P95 hos personer med nedsat nyrefunktion.
Nedsat leverfunktion
Ingen dosisjustering af FANAPT er nødvendig hos patienter med let nedsat leverfunktion. Patienter med moderat nedsat leverfunktion kan muligvis kræve dosisreduktion. FANAPT anbefales ikke til patienter med svær leverinsufficiens.
Hos voksne personer med let nedsat leverfunktion blev der ikke observeret nogen relevant forskel i farmakokinetik af iloperidon, P88 eller P95 (total eller ubundet) sammenlignet med raske voksne kontroller. Hos personer med moderat nedsat leverfunktion var en højere (to gange) og mere variabel fri eksponering for de aktive metabolitter P88 observeret sammenlignet med sunde kontroller, hvorimod eksponeringen for iloperidon og P95 generelt var ens (mindre end 50% ændring sammenlignet med styring). Da der ikke er foretaget en undersøgelse med alvorligt leverinsufficiens, anbefales FANAPT ikke til patienter med svær leverinsufficiens.
Rygestatus
Baseret på in vitro-undersøgelser, der anvender humane leverenzymer, er FANAPT ikke et substrat for CYP1A2; rygning bør derfor ikke have nogen indflydelse på FANAPTs farmakokinetik.
Graviditet
top
Narkotikamisbrug og afhængighed
Kontrolleret stof
FANAPT er ikke et kontrolleret stof.
Misbrug
FANAPT er ikke systematisk undersøgt hos dyr eller mennesker på grund af dets potentiale for misbrug, tolerance eller fysisk afhængighed. Mens de kliniske forsøg ikke afslørede nogen tendens for lægemiddel-søgende adfærd, var disse observationer ikke systematiske, og det er ikke muligt at forudsige på baggrund af denne erfaring, i hvilket omfang et CNS-aktivt stof, FANAPT, vil blive misbrugt, omdirigeret og / eller misbrugt en gang markedsført. Derfor bør patienter evalueres omhyggeligt for en historie med stofmisbrug, og sådanne patienter bør være observeret nøje for tegn på misbrug eller misbrug af FANAPT (f.eks. udvikling af tolerance, stigning i dosis, lægemiddel-søgning opførsel).
top
overdosering
Menneskelig oplevelse
I før-markedsføringsforsøg med over 3210 patienter var der tilfældig overdreven overdosis af FANAPT dokumenteret hos 8 patienter fra 48 mg til 576 mg taget på én gang og 292 mg taget over en 3-dages periode. Der blev ikke rapporteret omkomne af disse tilfælde. Den største bekræftede enkeltindtagelse af FANAPT var 576 mg; der blev ikke bemærket skadelige fysiske virkninger for denne patient. Den næste største bekræftede indtagelse af FANAPT var 438 mg over en 4-dages periode; ekstrapyramidale symptomer og et QTc-interval på 507 msek blev rapporteret for denne patient uden hjertesekvenser. Denne patient genoptog FANAPT-behandlingen i yderligere 11 måneder.
Generelt var rapporterede tegn og symptomer dem, der stammede fra en overdrivelse af de kendte farmakologiske virkninger (fx døsighed og sedation, takykardi og hypotension) af FANAPT.
Håndtering af overdosering
Der er ingen specifik modgift for FANAPT. Derfor bør der indføres passende støttende foranstaltninger. I tilfælde af akut overdosis skal lægen etablere og vedligeholde en luftvej og sikre tilstrækkelig iltning og ventilation. Gastrisk skylning (efter intubation, hvis patienten er bevidstløs) og administration af aktivt kul sammen med et afføringsmiddel skal overvejes. Muligheden for obtundation, anfald eller dystonisk reaktion af hovedet og nakken efter overdosering kan skabe risiko for aspiration med induceret emesis. Kardiovaskulær overvågning skal påbegyndes øjeblikkeligt og bør omfatte kontinuerlig EKG-overvågning for at påvise mulige arytmier. Hvis der administreres antiarytmisk behandling, bør disopyramid, procainamid og quinidin ikke anvendes, da de har potentialet til QT-forlængende virkninger, der kan være additive for FANAPT. Tilsvarende er det rimeligt at forvente, at de alfa-blokerende egenskaber af bretylium kan være additive til FANAPT's egenskaber, hvilket resulterer i problematisk hypotension. Hypotension og kredsløbskollaps bør behandles med passende foranstaltninger, såsom intravenøs væske eller sympatomimetiske midler (epinephrin og dopamin bør ikke anvendes, da beta-stimulering kan forværre hypotension i indstillingen af FANAPT-induceret alfa blokade). I tilfælde af svære ekstrapyramidale symptomer skal antikolinerg medicin administreres. Tæt lægelig tilsyn bør fortsætte, indtil patienten er kommet sig.
top
Beskrivelse
FANAPT er et atypisk antipsykotikum, der hører til den kemiske klasse af piperidinyl-benzisoxazolderivater. Dets kemiske navn er 4 '- [3- [4- (6-Fluoro-1,2-benzisoxazol-3-yl) piperidino] propoxy] -3'-methoxyacetophenon. Dens molekylformel er C24H27FN2O4, og dens molekylvægt er 426,48. Strukturformlen er:
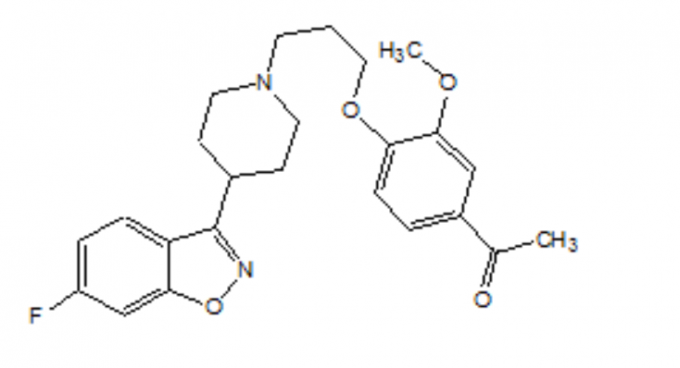
Iloperidon er et hvidt til off-white fint krystallinsk pulver. Det er praktisk taget uopløseligt i vand, meget let opløseligt i 0,1 N HCI og frit opløseligt i chloroform, ethanol, methanol og acetonitril.
FANAPT tabletter er kun beregnet til oral indgivelse. Hver runde, ubelagt
tablet indeholder 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg eller 12 mg iloperidon. Inaktive ingredienser er: lactosemonohydrat, mikrokrystallinsk cellulose, hydroxypropylmethylcellulose, crospovidon, magnesiumstearat, kolloid silicium
dioxid og oprenset vand (fjernet under forarbejdning). Tabletterne er hvide, runde, flade, skrå kantede og identificeret med et logo “” præget på den ene side og tabletstyrken “1”, “2”, “4”, “6”, “8”, “10”, eller “12” preget på den anden side.
top
Klinisk farmakologi
Handlingsmekanisme
Iloperidons virkningsmekanisme ved skizofreni er ukendt. Imidlertid kan effektiviteten af iloperidon medieres gennem en kombination af dopamin type 2 (D2) og serotonin type 2 (5-HT2) antagonisme.
Iloperidon danner en aktiv metabolit, P88, der har en in vitro-receptorbindingsprofil, der ligner modermedicinen.
farmakodynamik
Iloperidon fungerer som en antagonist med høj (nM) affinitetsbinding til serotonin 5-HT2A dopamin D2 og D3-receptorer og norepinephrin NEal-receptorer (Ki-værdier på 5,6, 6,3, 7,1 og 0,36 nM, henholdsvis). Iloperidon har moderat affinitet for dopamin D4 og serotonin 5-HT6 og 5-HT7 receptorer (Ki-værdier på 25, 43 og 22, nM henholdsvis) og lav affinitet for serotonin 5-HT1A, dopamin D1 og histamin H1 receptorer (Ki-værdier på 168, 216 og 437 nM, henholdsvis). Iloperidon har ingen mærkbar affinitet (Ki> 1000 nM) for kolinerge muskarine receptorer. Affiniteten af iloperidonmetabolit P88 er generelt lig med eller mindre end moderforbindelsen, medens kun metabolit P95 viser affinitet for 5-HT2A (Ki-værdi på 3,91) og NEalAA, NEalB, NEalD og NEa2C receptorer (Ki værdier 4,7, 2,7, 8,8 og 4,7 nM henholdsvis).
Farmakokinetik
Den observerede gennemsnitlige eliminationshalveringstid for iloperidon, P88 og P95 i CYP2D6 omfattende metabolisatorer (EM) er henholdsvis 18, 26 og 23 timer og i dårlig metaboliseringsmiddel (PM) er henholdsvis 33, 37 og 31 timer. Koncentrationer ved stabil tilstand opnås inden for 3 - 4 dage efter dosering. Iloperidon-akkumulering er forudsigelig ud fra en enkeltdosis farmakokinetik. Iloperidons farmakokinetik er mere end dosisforholdsmæssigt. Eliminering af iloperidon sker hovedsageligt gennem levermetabolisme, der involverer 2 P450 isozymer, CYP2D6 og CYP3A4.
Absorption: Iloperidon absorberes godt efter administration af tabletten med maksimale plasmakoncentrationer, der forekommer inden for 2 til 4 timer; medens den relative biotilgængelighed af tabletformuleringen sammenlignet med oral opløsning er 96%. Administration af iloperidon sammen med et standardmåltid med højt fedtindhold påvirkede ikke signifikant Cmax eller AUC af iloperidon, P88 eller P95, men forsinkede Tmax med 1 time for iloperidon, 2 timer for P88 og 6 timer i P95. FANAPT kan administreres uden hensyntagen til måltider.
Distribution: Iloperidon har en tilsyneladende clearance (clearance / biotilgængelighed) på 47 til 102 L / h, med et tilsyneladende distributionsvolumen på 1340-2800 L. Ved terapeutiske koncentrationer er den ubundne fraktion af iloperidon i plasma ~ 3%, og for hver metabolit (P88 og P95) er den ~ 8%.
Metabolisme og eliminering: Iloperidon metaboliseres primært ved 3 biotransformationstier: carbonylreduktion, hydroxylering (medieret af CYP2D6) og O-demethylering (medieret af CYP3A4). Der er 2 overvejende iloperidonmetabolitter, P95 og P88. Iloperidonmetabolitten P95 repræsenterer 47,9% af AUOP for iloperidon og dets metabolitter i plasma ved stabil tilstand for ekstensiv metabolisator (EM) og 25% for dårlig metabolisator (PM). Den aktive metabolit P88 udgør henholdsvis 19,5% og 34,0% af den samlede plasmaeksponering i EM og PM.
Cirka 7% -10% af kaukasiere og 3% -8% af sorte / afroamerikanere mangler kapacitet til at metabolisere CYP2D6 substrater og klassificeres som dårlig metabolisator (PM), mens resten er mellemliggende, omfattende eller ultrarapid omsættere. Samtidig administration af FANAPT med kendte stærke hæmmere af CYP2D6 som fluoxetin resulterer i en 2,3 gange stigning i iloperidon-plasmaeksponering, og derfor bør halvdelen af FANAPT-dosis være administreret.
Tilsvarende har PM's af CYP2D6 højere eksponering for iloperidon sammenlignet med EM'er, og PM'er bør have deres dosis reduceret med halvdelen. Laboratorietest er tilgængelige for at identificere CYP2D6 PM'er.
Størstedelen af de radioaktive materialer blev udvundet i urinen (gennemsnit 58,2% og 45,1% i henholdsvis EM og PM), med afføring svarende til 19,9% (EM) til 22,1% (PM) af den doserede radioaktivitet.
Transporter-interaktion: Iloperidon og P88 er ikke substrater for P-gp, og iloperidon er en svag P-gp-hæmmer.
top
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, forringelse af fertilitet
Karcinogenese: Karcinogenicitetsundersøgelser i levetid blev udført i CD-1-mus og Sprague Dawley-rotter. Iloperidon blev administreret oralt i doser på 2,5, 5,0 og 10 mg / kg / dag til CD-1 mus og 4, 8 og 16 mg / kg / dag til Sprague Dawley-rotter (henholdsvis 0,5, 1,0 og 2,0 gange henholdsvis 1,6, 3,2 og 6,5 gange MRHD på 24 mg / dag på en mg / m2 basis). Der var en forøget forekomst af ondartede brystkirteltumorer hos hunmus kun behandlet med den laveste dosis (2,5 mg / kg / dag). Der var ingen behandlingsrelaterede stigninger i neoplasi hos rotter.
Det kræftfremkaldende potentiale af iloperidonmetabolitten P95, som er en vigtig cirkulationsmetabolit af iloperidon hos mennesker, men ikke er til stede i signifikante mængder hos mus eller rotter blev vurderet i en levetid kræftfremkaldende undersøgelse i Wistar-rotter ved orale doser på 25, 75 og 200 mg / kg / dag hos mænd og 50, 150 og 250 (reduceret fra 400) mg / kg / dag i hunner. Lægemiddelrelaterede neoplastiske forandringer forekom hos mænd, i hypofysen (pars distalis adenoma) ved alle doser og i bugspytkirtlen (øcelleadenom) ved den høje dosis. Plasmaniveauer af P95 (AUC) hos mænd i de testede doser (25, 75 og 200 mg / kg / dag) var henholdsvis ca. 0,4, 3 og 23 gange den menneskelige eksponering for P95 ved MRoper af iloperidon.
Mutagenese: Iloperidon var negativ i Ames-testen og i in vivo-knoglemarvs- og rottelever-mikronukleustest. Iloperidon inducerede kromosomale afvigelser i kinesiske Hamster Ovarium (CHO) celler in vitro ved koncentrationer, der også forårsagede en vis cytotoksicitet.
Iloperidonmetabolitten P95 var negativ i Ames-testen, V79-kromosomafvigelsestesten og en in vivo-knoglemarvs-mikronukleustest.
Nedsat fertilitet: Iloperidon nedsatte fertiliteten ved 12 og 36 mg / kg i en undersøgelse, hvor både han- og hunrotter blev behandlet. Dosis uden virkning var 4 mg / kg, hvilket er 1,6 gange MRHD på 24 mg / dag på mg / m2-basis.
top
Kliniske studier
Effekten af FANAPT i behandlingen af skizofreni blev understøttet af 2 placebo- og aktiv-kontrollerede kortvarige (4- og 6-ugers) forsøg og en langtids placebokontrolleret randomiseret tilbagetrækningsforsøg. Alle forsøg inkluderede patienter, der opfyldte DSM-III / IV-kriterierne for skizofreni.
Tre instrumenter blev anvendt til vurdering af psykiatriske tegn og symptomer i disse undersøgelser. Den positive og negative syndromskala (PANSS) og den korte psykiatriske vurderingsskala (BPRS) er begge varebeholdninger af flere poster.
af generel psykopatologi, der normalt bruges til at evaluere virkningerne af lægemiddelbehandling i skizofreni. Evalueringen af klinisk global indtryk (CGI) afspejler indtrykket af en dygtig observatør, der er fuldt kendt med manifestationerne af skizofreni, om patientens samlede kliniske tilstand.
Et 6-ugers, placebokontrolleret forsøg (n = 706) involverede 2 fleksible dosisområder af FANAPT (12-16 mg / dag eller 20-24 mg / dag) sammenlignet med placebo og en aktiv kontrol (risperidon). For gruppen 12-16 mg / dag var titreringsplanen for FANAPT 1 mg to gange dagligt på dag 1 og 2, 2 mg to gange dagligt på dag 3 og 4, 4 mg to gange dagligt på dag 5 og 6 og 6 mg to gange dagligt på dag 7. For gruppen 20-24 mg / dag var titreringsplanen for FANAPT 1 mg to gange dagligt på dag 1, 2 mg to gange dagligt på dag 2, 4 mg to gange dagligt på dag 3, 6 mg to gange dagligt på dag 4 og 5, 8 mg to gange dagligt på dag 6 og 10 mg to gange dagligt på dag 7. Det primære endepunkt var ændring fra basislinjen på BPRS-totalresultatet ved behandlingens afslutning (dag 42). Både 12-16 mg / dag og 20-24 mg / dag dosisområdet for FANAPT var bedre end placebo på BPRS-total score. Det antipsykotiske medikament med aktiv kontrol syntes at være bedre end FANAPT i dette forsøg inden for de første 2 uger, en konstatering, der delvis kan forklares med den hurtigere titrering, der var mulig for det narkotika. Hos patienter i denne undersøgelse, som forblev i behandling i mindst 2 uger, så det ud til, at iloperidon havde haft sammenlignelig virkning med den aktive kontrol.
Et 4-ugers placebokontrolleret forsøg (n = 604) involverede en fast dosis FANAPT (24 mg / dag) sammenlignet med placebo og en aktiv kontrol (ziprasidon). Titreringsplanen for denne undersøgelse svarede til den for 6-ugers undersøgelse. Denne undersøgelse involverede titrering af FANAPT startende med 1 mg to gange dagligt på dag 1 og steg til 2, 4, 6, 8, 10 og 12 mg to gange dagligt på dag 2, 3, 4, 5, 6 og 7. Det primære endepunkt var ændring fra baseline på PANSS-totalresultatet efter behandlingssluttet (dag 28). FANAPT-dosis på 24 mg / dag var bedre end placebo i PANSS-totalresultatet. FANAPT syntes at have lignende effektivitet som det aktive kontrollægemiddel, som også krævede en langsom titrering til måldosis.
I et længerevarende forsøg opfyldte klinisk stabile voksne ambulante patienter (n = 303) DSM-IV kriterier for skizofreni, som forblev stabile efter 12 uger med åben behandling med fleksible doser FANAPT (8 mg / dag - 24 mg / dag indgivet som to gange daglige doser) blev randomiseret til placebo eller for at fortsætte med deres nuværende FANAPT-dosis (8 mg / dag - 24 mg / dag indgivet som to gange daglige doser) til observation for mulig tilbagefald under dobbeltblind tilbagefald forebyggelsesfase. Stabilisering i den åbne fase blev defineret som at være på en fastlagt dosis FANAPT, som var uændret på grund af effektiviteten i de 4 uger før randomisering, med CGI-Severity-score på ≤4 og PANSS-total score ≤70, en score på ≤4 på hver af de følgende individuelle PANSS-poster (P1-vrangforestillinger, P2-konceptuel disorganisering, P3-hallucinatorisk opførsel, P6-mistænksomhed / forfølgelse, P7-fjendtlighed eller G8-manglende samarbejdsevne), og ingen hospitalisering eller stigning i plejeniveau til behandling eksacerbationer. Tilbagefald eller forestående tilbagefald i den dobbeltblinde forebyggelse af tilbagefald blev defineret som nogen af følgende: indlæggelse på grund af forværring af skizofreni, stigning (forværring) af PANSS samlede score ≥30%, CGI-
Forbedringsscore ≥6, patienten havde selvmords-, homicid- eller aggressiv opførsel eller behov for anden antipsykotisk medicin.

Baseret på interimsanalysen besluttede et uafhængigt dataovervågningsudvalg, at undersøgelsen skulle afbrydes tidligt på grund af bevis for effektivitet. Baseret på resultater fra interimsanalysen, som blev bekræftet af det endelige analysedatasæt, blev patienter behandlet med FANAPT oplevede en statistisk signifikant længere tid til tilbagefald eller forestående tilbagefald end patienter, der modtog placebo. Figur 1 viser den estimerede kumulative andel af patienter med tilbagefald eller forestående tilbagefald baseret på det endelige datasæt.
top
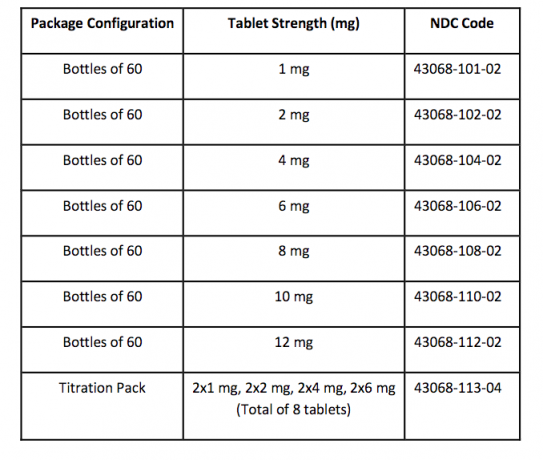
Hvordan leveres / opbevaring og håndtering
FANAPT tabletter er hvide, runde og identificeret med et logo præget på den ene side og tabletstyrken "1", "2", "4", "6", "8", "10" eller "12" preget på den anden side. Tabletter leveres i følgende styrker og pakkekonfigurationer:
Opbevaring
Opbevar FANAPT-tabletter ved kontrolleret stuetemperatur, 25 ° C (77 ° F); udflugter tilladt til 15 ° til 30 ° C (59 ° til 86 ° F) [Se USP kontrolleret rumtemperatur]. Beskyt FANAPT-tabletter mod eksponering for lys og fugt.
PASIENT RÅDINFORMATION
Læger rådes til at diskutere følgende problemer med patienter, som de ordinerer FANAPT for:
Forlængelse af QT-interval
Patienter bør rådes til straks at konsultere deres læge, hvis de føler sig svage, mister bevidsthed eller har hjertebanken. Patienter bør rådes om ikke at tage FANAPT sammen med andre lægemidler, der forårsager forlængelse af QT-intervallet. Patienterne skal få besked om at informere læger om, at de tager FANAPT, inden der tages noget nyt lægemiddel.
Neuroleptisk malignt syndrom
Patienter og plejepersonale skal rådes om, at et potentielt dødeligt symptomkompleks undertiden henvises til som NMS er rapporteret i forbindelse med administration af antipsykotiske medikamenter, herunder FANAPT. Tegn og symptomer på NMS inkluderer hyperpyrexia, muskelstivhed, ændret mental status og bevis for autonom
ustabilitet (uregelmæssig puls eller blodtryk, takykardi, diaphorese og hjertedrytmi).
Metabolske ændringer
Patienter skal være opmærksomme på symptomerne på hyperglykæmi (højt blodsukker) og diabetes mellitus. Patienter, der er diagnosticeret med diabetes, patienter med risikofaktorer for diabetes eller dem, der udvikler disse symptomer under behandlingen skal have deres blodsukkerovervågning i begyndelsen af og med jævne mellemrum behandling. Patienter skal informeres om, at der er sket vægtøgning under behandling med FANAPT. Klinisk monitorering af vægt anbefales.
Ortostatisk hypotension
Patienter bør informeres om risikoen for ortostatisk hypotension, især på tidspunktet for behandlingsstart, genoptagelse af behandling eller forøgelse af dosis.
Interferens med kognitiv og motorisk ydeevne
Da FANAPT kan have potentialet til at forringe dømmekraft, tænkning eller motoriske færdigheder, skal patienter advares om betjening af farlige maskiner, inklusive biler, indtil de med rimelighed er sikre på, at FANAPT-terapi ikke påvirker dem negativt.
Graviditet
Rådgiv patienter om, at brug af Fanapt i tredje trimester kan forårsage ekstrapyramidale og / eller abstinenssymptomer hos en nyfødt. Rådgiv patienter til at give deres sundhedsudbyder besked med kendt eller mistænkt graviditet.
Graviditetsregister
Rådgiver patienter om, at der er et register over eksponering for graviditet, der overvåger graviditetsresultater hos kvinder, der udsættes for FANAPT under graviditet
Amning
Rådgiv kvinder om ikke at amme under behandling med FANAPT.
Samtidig medicin
Patienter bør rådes til at informere deres læger, hvis de tager eller planlægger at tage recept, receptpligtig medicin eller over-the -ounter-medicin, da der er potentiale for interaktion.
Alkohol
Patienter bør rådes til at undgå alkohol, mens de tager FANAPT.
Varmeeksponering og dehydrering
Patienter bør informeres om passende pleje for at undgå overophedning og dehydrering.
Distribueret af:
Vanda Pharmaceuticals Inc.
Washington, D.C. 20037 USA
Vanda og Fanapt® er registrerede varemærker tilhørende Vanda Pharmaceuticals Inc. i USA og andre lande.
Tilbage til toppen
Fanapt (Iloperidone) receptvejledning (PDF)
Oplysningerne i denne monografi er ikke beregnet til at dække alle mulige anvendelser, instruktioner, forholdsregler, medikamentinteraktion eller ugunstige virkninger. Denne information er generaliseret og er ikke beregnet til specifik medicinsk rådgivning. Hvis du har spørgsmål til de lægemidler, du tager eller ønsker flere oplysninger, skal du kontakte din læge, apotek eller sygeplejerske.
sidst opdateret 07/13
tilbage til: Psykiatrisk medicin Farmakologisk hjemmeside



