Avandia til behandling af diabetes
Brand name: AVANDIA
Generisk navn: rosiglitazonmaleat
Indhold:
Indikationer og anvendelse
Dosering og administration
Doseringsformer og -stærker
Kontraindikationer
Advarsler og forsigtighedsregler
Bivirkninger
Lægemiddelinteraktioner
Brug i specifikke befolkninger
overdosering
Beskrivelse
Klinisk farmakologi
Ikke-klinisk toksikologi
Kliniske studier
Hvordan leveres
Avandia, rosiglitazonmaleat, patientinformation (på almindeligt engelsk)
ADVARSEL
KONGESTIV HJERTFELT OG MYOCARDIAL ISCHEMIA
- Thiazolidinedioner, inklusive rosiglitazon, forårsager eller forværrer kongestiv hjertesvigt hos nogle patienter [se ADVARSLER OG FORHOLDSREGLER]. Efter initiering af AVANDIA, og efter stigning i dosis, skal patienterne følges omhyggeligt for tegn og symptomer på hjertesvigt (inklusive overdreven, hurtig vægtøgning, dyspnø og / eller ødemer). Hvis disse tegn og symptomer udvikler sig, skal hjertesvigt håndteres i henhold til de aktuelle plejestandarder. Desuden skal seponering eller dosisreduktion af AVANDIA overvejes.
- AVANDIA anbefales ikke til patienter med symptomatisk hjertesvigt. Påbegyndelse af AVANDIA hos patienter med etableret NYHA klasse III eller IV hjertesvigt er kontraindiceret. [Se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER.]
- En metaanalyse af 42 kliniske studier (gennemsnitlig varighed 6 måneder; 14.237 samlede patienter), hvoraf de fleste sammenlignede AVANDIA med placebo, viste at AVANDIA var forbundet med en øget risiko for myokardie-iskæmiske begivenheder såsom angina eller hjerteinfarkt. Tre andre undersøgelser (gennemsnitlig varighed 41 måneder; 14.067 samlede patienter), sammenlignet AVANDIA med nogle andre godkendte orale antidiabetika eller placebo, har ikke bekræftet eller udelukket denne risiko. I deres helhed er de tilgængelige data om risikoen for myokardisk iskæmi ikke entydige. [Se ADVARSLER OG FORHOLDSREGLER.]
top
Indikationer og anvendelse
Monoterapi og kombinationsterapi
AVANDIA er indikeret som et supplement til diæt og motion for at forbedre den glykæmiske kontrol hos voksne med type 2-diabetes mellitus.
Vigtige begrænsninger i brugen
- På grund af dens virkningsmekanisme er AVANDIA kun aktiv i nærvær af endogent insulin. Derfor bør AVANDIA ikke bruges til patienter med type 1 diabetes mellitus eller til behandling af diabetisk ketoacidose.
- Samtidig administration af AVANDIA og insulin anbefales ikke.
- Brug af AVANDIA sammen med nitrater anbefales ikke.
top
Dosering og administration
Håndteringen af antidiabetisk behandling bør individualiseres. Alle patienter skal starte AVANDIA med den laveste anbefalede dosis. Yderligere stigninger i dosen af AVANDIA skal ledsages af nøje overvågning af bivirkninger relateret til væskeretention [se Boxed Advarsel og ADVARSLER OG FORHOLDSREGLER].
AVANDIA kan administreres i en startdosis på 4 mg enten som en enkelt daglig dosis eller i 2 opdelte doser. For patienter, der reagerer utilstrækkeligt efter 8 til 12 ugers behandling, bestemt ved reduktion i fastende plasmaglukose (FPG), kan dosis øges til 8 mg dagligt som monoterapi eller i kombination med metformin, sulfonylurea eller sulfonylurea plus metformin. Reduktioner i glykæmiske parametre ved dosis og regimen er beskrevet under Kliniske studier. AVANDIA kan tages med eller uden mad.
Den samlede daglige dosis AVANDIA bør ikke overstige 8 mg.
monoterapi
Den sædvanlige startdosis af AVANDIA er 4 mg administreret enten som en enkelt dosis en gang dagligt eller i opdelte doser to gange dagligt. I kliniske forsøg resulterede 4 mg-behandlingen to gange dagligt i den største reduktion i FPG og hæmoglobin A1c (HbA1c).
Kombination med sulfonylurinstof eller metformin
Når AVANDIA føjes til den eksisterende terapi, kan den / de aktuelle dosis (er) af midlet / midlene fortsættes efter påbegyndelse af behandlingen med AVANDIA.
sulfonylurinstof: Når den anvendes i kombination med sulfonylurinstof, er den sædvanlige startdosis af AVANDIA 4 mg administreret som enten en enkelt dosis en gang dagligt eller i opdelte doser to gange dagligt. Hvis patienter rapporterer hypoglykæmi, skal dosis af sulfonylurinstof reduceres.
Metformin: Den sædvanlige startdosis af AVANDIA i kombination med metformin er 4 mg indgivet som enten en enkelt dosis en gang dagligt eller i opdelte doser to gange dagligt. Det er usandsynligt, at dosis af metformin kræver justering på grund af hypoglykæmi under kombinationsbehandling med AVANDIA.
Kombination med Sulfonylurea Plus Metformin
Den sædvanlige startdosis af AVANDIA i kombination med en sulfonylurinstof plus metformin er 4 mg indgivet som enten en enkelt dosis en gang dagligt eller opdelte doser to gange dagligt. Hvis patienter rapporterer hypoglykæmi, skal dosis af sulfonylurinstof reduceres.
Specifikke patientpopulationer
Nedsat nyrefunktion: Ingen dosisjustering er nødvendig, når AVANDIA anvendes som monoterapi hos patienter med nedsat nyrefunktion. Da metformin er kontraindiceret til sådanne patienter, er samtidig administration af metformin og AVANDIA også kontraindiceret til patienter med nedsat nyrefunktion.
Nedsat leverfunktion: Leverenzymer skal måles inden behandling med AVANDIA påbegyndes. Behandling med AVANDIA bør ikke påbegyndes, hvis patienten udviser klinisk bevis for, at den er aktiv leversygdom eller forhøjede serumtransaminasniveauer (ALT> 2,5X øvre grænse for normal ved starten af terapi). Efter påbegyndelse af AVANDIA skal leverenzymer regelmæssigt overvåges i henhold til den kliniske vurdering af sundhedspersonalet. [Se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI.]
Pædiatrisk: Data er utilstrækkelige til at anbefale pædiatrisk brug af AVANDIA [se BRUG I SPECIFIKKE BEVILKNINGER].
top
Doseringsformer og styrker
Pentagonal filmovertrukket TILTAB-tablet indeholder rosiglitazon som maleat som følger:
- 2 mg - lyserød, præget med SB på den ene side og 2 på den anden
- 4 mg - orange, preget med SB på den ene side og 4 på den anden
- 8 mg - rødbrun, præget med SB på den ene side og 8 på den anden
top
Kontraindikationer
Påbegyndelse af AVANDIA hos patienter med etableret New York Heart Association (NYHA) hjerteinsufficiens klasse III eller IV er kontraindiceret [se BOKSET ADVARSEL].
top
Advarsler og forsigtighedsregler
Hjertesvigt
AVANDIA, som andre thiazolidinedioner, alene eller i kombination med andre antidiabetika kan forårsage væskeretention, hvilket kan forværre eller føre til hjertesvigt. Patienter skal overholdes for tegn og symptomer på hjertesvigt. Hvis disse tegn og symptomer udvikler sig, skal hjertesvigt håndteres i henhold til de aktuelle plejestandarder. Endvidere skal seponering eller dosisreduktion af rosiglitazon overvejes [se BOKSET ADVARSEL].
Patienter med kongestiv hjertesvigt (CHF) NYHA klasse I og II behandlet med AVANDIA har en øget risiko for hjerte-kar-hændelser. En 52-ugers, dobbeltblind, placebokontrolleret ekkokardiografisk undersøgelse blev udført hos 224 patienter med type 2 diabetes mellitus og NYHA klasse I eller II CHF (udsprøjtningsfraktion - 45%) på antidiabetisk baggrund og CHF terapi. Et uafhængigt udvalg gennemførte en blindet evaluering af væskerelaterede begivenheder (inklusive kongestiv hjertesvigt) og hjerte-kar-hospitaliseringer i henhold til foruddefinerede kriterier (Jury). Bortset fra vurderingen blev andre kardiovaskulære bivirkninger rapporteret af efterforskere. Selvom der ikke blev observeret nogen behandlingsforskel i ændring fra udgangsfraktionens baseline, mere kardiovaskulære bivirkninger blev observeret efter behandling med AVANDIA sammenlignet med placebo i løbet af 52-ugers undersøgelse. (Se tabel 1.)
Tabel 1. Emergent Cardiovascular Bivirkninger hos patienter med kongestiv hjertesvigt (NYHA klasse I og II) behandlet med AVANDIA eller placebo (i tillæg til antidiabetisk baggrund og CHF-terapi)
| Begivenheder | AVANDIA N = 110 n (%) |
Placebo N = 114 n (%) |
| afgøres | ||
| Kardiovaskulære dødsfald | 5 (5%) | 4 (4%) |
| CHF forværres | 7 (6%) | 4 (4%) |
| - med indlæggelse natten over | 5 (5%) | 4 (4%) |
| - uden indlæggelse natten over | 2 (2%) | 0 (0%) |
| Nyt eller forværret ødem | 28 (25%) | 10 (9%) |
| Ny eller forværring af dyspnø | 29 (26%) | 19 (17%) |
| Stigninger i CHF-medicin | 36 (33%) | 20 (18%) |
| Kardiovaskulær hospitalisering * | 21 (19%) | 15 (13%) |
| Undersøgelsesrapporteret, ikke bedømt | ||
| Iskæmiske bivirkninger | 10 (9%) | 5 (4%) |
| - Myokardieinfarkt | 5 (5%) | 2 (2%) |
| - Angina | 6 (5%) | 3 (3%) |
| * Inkluderer hospitalisering af enhver hjerte-kar-årsag. |
Påbegyndelse af AVANDIA hos patienter med etableret NYHA klasse III eller IV hjertesvigt er kontraindiceret. AVANDIA anbefales ikke til patienter med symptomatisk hjertesvigt. [Se BOKSET ADVARSEL.]
Patienter, der oplever akutte koronarsyndromer, er ikke undersøgt i kontrollerede kliniske forsøg. I betragtning af potentialet for udvikling af hjertesvigt hos patienter, der har en akut koronar begivenhed, er initiering af AVANDIA ikke anbefales til patienter, der oplever en akut koronar begivenhed, og seponering af AVANDIA i denne akutte fase skal ske taget i betragtning.
Patienter med hjertestatus i NYHA klasse III og IV (med eller uden CHF) er ikke undersøgt i kontrollerede kliniske forsøg. AVANDIA anbefales ikke til patienter med NYHA klasse III og IV hjertestatus.
Myokardie-iskæmi
Metaanalyse af myokardie-iskæmi i en gruppe af 42 kliniske forsøg
En metaanalyse blev udført retrospektivt for at vurdere kardiovaskulære bivirkninger rapporteret i 42 dobbeltblinde, randomiserede, kontrollerede kliniske forsøg (gennemsnitlig varighed 6 måneder).1
Disse undersøgelser var blevet udført for at vurdere glukosesænkende effektivitet i type 2-diabetes, og der var ikke forekommet planlagt vurdering af hjerte-kar-hændelser i forsøgene. Nogle forsøg var placebokontrolleret, og nogle brugte aktive orale antidiabetika som kontroller. Placebo-kontrollerede studier inkluderede monoterapiforsøg (monoterapi med AVANDIA versus placebo monoterapi) og tilføjelsesforsøg (AVANDIA eller placebo, tilsat sulfonylurinstof, metformin eller insulin). Aktive kontrolundersøgelser omfattede monoterapiforsøg (monoterapi med AVANDIA versus sulfonylurea eller metformin monoterapi) og add-on-forsøg (AVANDIA plus sulfonylurea eller AVANDIA plus metformin, versus sulfonylurea plus metformin). I alt blev 14.237 patienter inkluderet (8.604 i behandlingsgrupper indeholdende AVANDIA, 5.633 i komparatorgrupper), med 4.143 patientårs eksponering for AVANDIA og 2.675 patientårs eksponering for komparator. Myokardielle iskæmiske hændelser inkluderede angina pectoris, angina pectoris forværret, ustabil angina, hjertestop, brystsmerter, koronar arterieindeslutning, dyspnø, hjerteinfarkt, koronar trombose, myokard iskæmi, koronar arteriesygdom og koronar arterie sygdom. I denne analyse er en øget risiko for myokardisk iskæmi med AVANDIA sammenlignet med kombinerede komparatorer blev observeret (2% AVANDIA mod 1,5% komparatorer, oddsforhold 1,4, 95% konfidensinterval [CI] 1,1, 1.8). I de placebokontrollerede studier blev der observeret en øget risiko for iskæmiske myokardielle begivenheder med AVANDIA, men ikke i de aktivt kontrollerede studier. (Se figur 1.)
En større øget risiko for myokardie-iskæmiske begivenheder blev observeret i studier, hvor AVANDIA blev tilføjet til insulin (2,8% for AVANDIA plus insulin mod 1,4% for placebo plus insulin, [ELLER 2,1, 95% Cl 0,9, 5.1]). Denne øgede risiko afspejler en forskel på 3 hændelser pr. 100 patientår (95% CI -0,1, 6,3) mellem behandlingsgrupper. [Se ADVARSLER OG FORHOLDSREGLER.]
Figur 1. Forest Plot of Odds Ratios (95% konfidensintervaller) for myokardielle iskæmiske begivenheder i metaanalyse af 42 kliniske forsøg
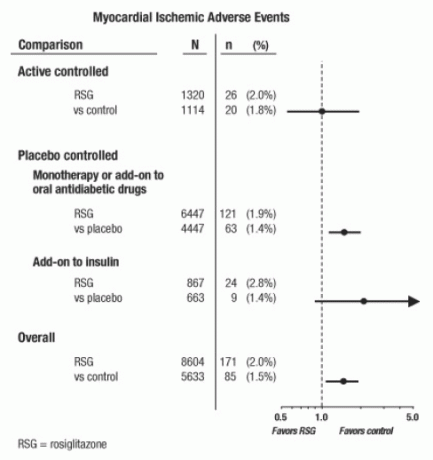
En større øget risiko for myokardisk iskæmi blev også observeret hos patienter, der modtog AVANDIA og baggrundnitratbehandling. For AVANDIA (N = 361) versus kontrol (N = 244) hos nitratbrugere var oddsforholdet 2,9 (95% Cl 1,4, 5,9), mens oddsforholdet for ikke-nitratbrugere (ca. 14.000 patienter i alt) var 1,3 (95% KI 0,9, 1.7). Denne øgede risiko repræsenterer en forskel på 12 myokardielle iskæmiske hændelser pr. 100 patientår (95% Cl 3,3, 21,4). De fleste af nitratbrugerne havde etableret koronar hjertesygdom. Blandt patienter med kendt koronar hjertesygdom, der ikke var i nitratbehandling, blev der ikke påvist en øget risiko for myokardie-iskæmiske hændelser for AVANDIA versus komparator.
Myokardielle iskæmiske begivenheder i store langsigtede prospektive, randomiserede kontrollerede forsøg med AVANDIA
Data fra 3 andre store, langvarige, prospektive, randomiserede, kontrollerede kliniske forsøg med AVANDIA blev vurderet separat fra metaanalysen. Disse 3 forsøg inkluderer i alt 14.067 patienter (behandlingsgrupper indeholdende AVANDIA N = 6.311, komparator gruppe N = 7,756), med en patientårs eksponering på 21,803 patientår for AVANDIA og 25,998 patientår for komparator. Opfølgningens varighed oversteg 3 år i hver undersøgelse. ADOPT (A Diabetes Outuits Progression Trial) var en 4- til 6-årig randomiseret, aktiv-kontrolleret undersøgelse i nyligt diagnosticerede patienter med type 2-diabetes, der ikke var gået til lægemiddelterapi.
Det var en effektivitets- og generel sikkerhedsundersøgelse, der var designet til at undersøge holdbarheden af
AVANDIA som monoterapi (N = 1.456) til glykæmisk kontrol i type 2-diabetes, med komparatorarme af sulfonylurinstof-monoterapi (N = 1.441) og metformin-monoterapi (N = 1.454). DREAM (Diabetesreduktionsvurdering med Rosiglitazone og Ramipril-medicin, offentliggjort rapport2) var en 3- til 5-årigt randomiseret, placebokontrolleret studie hos patienter med nedsat glukosetolerance og / eller nedsat faste glucose. Det havde en 2x2 fabriksdesign, beregnet til at evaluere effekten af AVANDIA og separat af ramipril (en angiotensin-konverterende enzyminhibitor [ACEI]) på progression til åbenlyst diabetes. I DREAM var 2.635 patienter i behandlingsgrupper indeholdende AVANDIA, og 2.634 var i behandlingsgrupper, der ikke indeholdt AVANDIA.Interimsresultater er blevet offentliggjort 3 for RECORD (Rosiglitazone evalueret for hjerteresultater og regulering af glukæmi i Diabetes), en igangværende åben 6-årig kardiovaskulær resultatundersøgelse hos patienter med type 2-diabetes med en gennemsnitlig behandling varighed på 3,75 år. RECORD inkluderer patienter, der har mislykket metformin eller sulfonylurinstof-monoterapi; dem, der har mislykket metformin, er randomiseret til at modtage enten add-on AVANDIA eller add-on sulfonylurea, og dem, der har fejlet sulfonylurinstof, er randomiseret til at modtage enten add-on AVANDIA eller add-on metformin. I RECORD modtager i alt 2.220 patienter add-on AVANDIA, og 2.227 patienter er i et af de tilføjelsesregimer, der ikke indeholder AVANDIA.
I disse 3 forsøg blev analyser udført ved anvendelse af en sammensætning af større bivirkninger i hjerte-kar-kar (myokardieinfarkt, hjerte-kar-død eller slagtilfælde), der i det følgende benævnt MACE. Dette slutpunkt adskiller sig fra metaanalysenes brede endepunkt for myokardielle iskæmiske begivenheder, hvoraf over halvdelen var angina. Myokardieinfarkt omfattede bedømt dødelig og ikke-dødelig hjerteinfarkt plus pludselig død. Som vist i figur 2 var resultaterne for de 3 slutpunkter (MACE, MI og Total Mortality) ikke statistisk signifikant forskellige mellem AVANDIA og komparatorer.
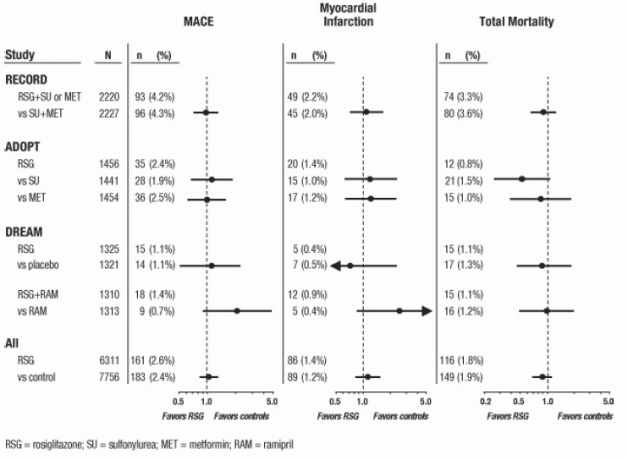
I foreløbige analyser af DREAM-forsøget var forekomsten af hjerte-kar-hændelser højere blandt personer, der modtog AVANDIA i kombination med ramipril end blandt personer, der modtog ramipril alene, som illustreret i Figur 2 Denne konstatering blev ikke bekræftet i ADOPT og RECORD (aktivt kontrollerede forsøg hos patienter med diabetes), hvor henholdsvis 30% og 40% af patienterne rapporterede om ACE-hæmmerbrug ved baseline.
I deres helhed er de tilgængelige data om risikoen for myokardisk iskæmi ikke entydige. Definitive konklusioner vedrørende denne risiko venter på afslutningen af en tilstrækkelig designet cardiovaskulær resultatundersøgelse.
Der har ikke været nogen kliniske undersøgelser, der viser, at der foreligger afgørende bevis for reduktion af makrovaskulær risiko med AVANDIA eller andre orale antidiabetika.
Kongestiv hjertesvigt og myokardie-iskæmi under samtidig administration af AVANDIA sammen med insulin
I studier, hvor AVANDIA blev føjet til insulin, øgede AVANDIA risikoen for kongestiv hjertesvigt og myokardisk iskæmi. (Se tabel 2.)
Samtidig administration af AVANDIA og insulin anbefales ikke. [Se Indikationer og anvendelse og ADVARSLER OG FORHOLDSREGLER.]
I fem, 26-ugers kontrollerede, randomiserede, dobbeltblinde forsøg, som var inkluderet i metaanalysen [se ADVARSLER OG FORHOLDSREGLER] blev patienter med type 2-diabetes mellitus randomiseret til samtidig administration af AVANDIA og insulin (N = 867) eller insulin (N = 663). I disse 5 forsøg blev AVANDIA tilsat insulin. Disse forsøg omfattede patienter med langvarig diabetes (median varighed på 12 år) og en høj forekomst af eksisterende medicinske tilstande, herunder perifer neuropati, retinopati, iskæmisk hjertesygdom, vaskulær sygdom og kongestivt hjerte fiasko. Det samlede antal patienter med opstået kongestiv hjertesvigt var henholdsvis 21 (2,4%) og 7 (1,1%) i AVANDIA plus insulin og insulingrupper. Det samlede antal patienter med opstået myokardie-iskæmi var 24 (2,8%) og 9 (1,4%) i henholdsvis AVANDIA plus insulin og insulingrupper (ELLER 2,1 [95% KI 0,9, 5,1]). Selvom hændelsesfrekvensen for kongestiv hjertesvigt og myokardie-iskæmi var lav i det undersøgte befolkning, var hændelsesfrekvensen konsekvent to gange eller højere ved samtidig administration af AVANDIA og insulin. Disse kardiovaskulære begivenheder blev observeret ved både 4 mg og 8 mg daglige doser af AVANDIA. (Se tabel 2.)
Tabel 2 Forekomst af kardiovaskulære hændelser i 5 kontrollerede forsøg med tilføjelse af AVANDIA til etableret insulinbehandling
| Begivenhed* | AVANDIA + Insulin (n = 867) n (%) |
Insulin (n = 663) n (%) |
| Kongestiv hjertesvigt | 21 (2.4%) | 7 (1.1%) |
| Myokardisk iskæmi | 24 (2.8%) | 9 (1.4%) |
| Sammensat af hjerte-kar-død, hjerteinfarkt eller slagtilfælde | 10 (1.2%) | 5 (0.8%) |
| Slag | 5 (0.6%) | 4 (0.6%) |
| Hjerteinfarkt | 4 (0.5%) | 1 (0.2%) |
| Kardiovaskulær død | 4 (0.5%) | 1 (0.2%) |
| Alle dødsfald | 6 (0.7%) | 1 (0.2%) |
| * Begivenheder er ikke eksklusive; dvs. en patient med en kardiovaskulær død på grund af en myokardieinfarkt ville blive talt i 4 hændelseskategorier (myokardie-iskæmi; hjerte-kar-død, hjerteinfarkt eller slagtilfælde; hjerteinfarkt; hjerte-kar-død). |
I et sjette, 24-ugers, kontrolleret, randomiseret, dobbeltblind forsøg med AVANDIA og samtidig administration af insulin blev insulin tilsat AVANDAMET® (rosiglitazonmaleat og metformin HCI) (n = 161) og sammenlignet med insulin plus placebo (n = 158), efter en enkeltblind 8-ugers run-in med AVANDAMET. Patienter med ødemer, der krævede farmakologisk behandling og patienter med kongestiv hjertesvigt, blev udelukket ved basislinjen og i løbet af indkøringsperioden.
I gruppen, der modtog AVANDAMET plus insulin, var der en myokardie-iskæmisk begivenhed og en pludselig død. Der blev ikke observeret myokardisk iskæmi i insulingruppen, og der blev ikke rapporteret nogen kongestiv hjertesvigt i nogen af behandlingsgrupperne.
Ødem
AVANDIA bør anvendes med forsigtighed til patienter med ødemer. I en klinisk undersøgelse med raske frivillige, der modtog 8 mg AVANDIA en gang dagligt i 8 uger, var der en statistisk signifikant stigning i median plasmavolumen sammenlignet med placebo.
Da thiazolidinedioner, inklusive rosiglitazon, kan forårsage væskeretention, hvilket kan forværre eller føre til kongestiv hjertesvigt, skal AVANDIA bruges med forsigtighed til patienter med risiko for hjerte fiasko. Patienter skal overvåges for tegn og symptomer på hjertesvigt [se BOKSET ADVARSEL, ADVARSLER OG FORHOLDSREGLER ].
I kontrollerede kliniske forsøg med patienter med type 2-diabetes blev der rapporteret mild til moderat ødem hos patienter, der blev behandlet med AVANDIA, og kan være dosisrelaterede. Patienter med løbende ødem var mere tilbøjelige til at have bivirkninger forbundet med ødemer, hvis de startede i kombinationsterapi med insulin og AVANDIA [se BIVIRKNINGER].
Vægtøgning
Dosisrelateret vægtøgning blev set kun med AVANDIA og i kombination med andre hypoglykæmiske midler (tabel 3). Mekanismen for vægtøgning er uklar, men involverer sandsynligvis en kombination af væskeretention og fedtophobning.
Efter markedsføring er der rapporteret om usædvanligt hurtige stigninger i vægt og stigninger ud over det, der generelt er observeret i kliniske forsøg. Patienter, der oplever sådanne stigninger, bør vurderes for væskeansamling og volumenrelaterede hændelser såsom overdreven ødemer og kongestiv hjertesvigt [se BOKSET ADVARSEL].
Tabel 3 Vægtændringer (kg) fra baseline ved slutpunkt under kliniske forsøg
| monoterapi | Varighed | Kontrolgruppe | AVANDIA 4 mg median (25., 75. percentil) |
AVANDIA 8 mg median (25., 75. percentil) |
|
| median (25., 75. percentil) | |||||
| 26 uger | placebo | -0.9 (-2.8, 0.9) n = 210 |
1.0 (-0.9, 3.6) n = 436 |
3.1 (1.1, 5.8) n = 439 |
|
| 52 uger | sulfonylurinstof | 2.0 (0, 4.0) n = 173 |
2.0 (-0.6, 4.0) n = 150 |
2.6 (0, 5.3) n = 157 |
|
| Kombinationsterapi | |||||
| sulfonylurinstof | 24-26 uger | sulfonylurinstof | 0 (-1.0, 1.3) n = 1.155 |
2.2 (0.5, 4.0) n = 613 |
3.5 (1.4, 5.9) n = 841 |
| Metformin | 26 uger | metformin | -1.4 (-3.2, 0.2) n = 175 |
0.8 (-1.0, 2.6) n = 100 |
2.1 (0, 4.3) n = 184 |
| Insulin | 26 uger | insulin | 0.9 (-0.5, 2.7) n = 162 |
4.1 (1.4, 6.3) n = 164 |
5.4 (3.4, 7.3) n = 150 |
| Sulfonylurea + metformin | 26 uger | sulfonylurinstof + metformin | 0.2 (-1.2, 1.6) n = 272 |
2.5 (0.8, 4.6) n = 275 |
4.5 (2.4, 7.3) n = 276 |
I en 4- til 6-årig, monoterapi, sammenlignende forsøg (ADOPT) hos patienter, der for nylig blev diagnosticeret med type 2-diabetes, som ikke tidligere er behandlet med antidiabetisk medicin [se Klinisk studies], medianvægtændringen (25th, 75th percentiler) fra baseline efter 4 år var 3,5 kg (0,0, 8,1) for AVANDIA, 2,0 kg (-1,0, 4,8) for glyburid og -2,4 kg (-5,4, 0,5) for metformin.
I en 24-ugers undersøgelse med pædiatriske patienter i alderen 10 til 17 år behandlet med AVANDIA 4 til 8 mg dagligt, var en medianvægtøgning på 2,8 kg (25 kg)th, 75th percentiler: 0,0, 5,8) blev rapporteret.
Levereffekter
Leverenzymer skal måles inden påbegyndelse af behandling med AVANDIA hos alle patienter og med regelmæssige mellemrum derefter efter den kliniske vurdering af sundhedspersonalet. Behandling med AVANDIA bør ikke påbegyndes hos patienter med øgede leverenzymniveauer i baseline (ALT> 2,5X øvre normalgrænse). Patienter med let forhøjede leverenzymer (ALT-niveauer - ‰ ¤ 2,5X øvre normalgrænse) ved baseline eller under behandling med AVANDIA skal evalueres for at bestemme årsagen til leverenzymet elevation. Påbegyndelse af eller fortsættelse af, behandling med AVANDIA hos patienter med mild leverenzymforhøjelse bør fortsætte med forsigtighed og inkluderer tæt klinisk opfølgning, herunder overvågning af leverenzym, for at bestemme, om leverenzymforhøjelserne løser eller forværres. Hvis ALT-niveauerne til enhver tid stiger til> 3X den øvre normalgrænse hos patienter, der er i behandling med AVANDIA, skal leverenzymniveauer genkontrolleres så hurtigt som muligt. Hvis ALT-niveauer forbliver> 3X den øvre normale grænse, bør behandling med AVANDIA seponeres.
Hvis en patient udvikler symptomer, der antyder leverdysfunktion, som kan omfatte uforklarlig kvalme, opkast, mavesmerter, træthed, anorexi og / eller mørk urin, skal leverenzymer kontrolleres. Beslutningen om, hvorvidt patienten skal fortsætte behandlingen med AVANDIA, bør styres af en klinisk vurdering i afventning af laboratorievurderinger. Hvis der observeres gulsot, skal lægemiddelbehandling seponeres. [Se BIVIRKNINGER.]
Makulær ødem
Makulært ødem er rapporteret efter markedsføring hos nogle diabetespatienter, der tog AVANDIA eller en anden thiazolidinedion. Nogle patienter præsenteres med sløret syn eller nedsat synsskarphed, men nogle patienter ser ud til at være diagnosticeret ved rutinemæssig øjenundersøgelse. De fleste patienter havde perifert ødem på det tidspunkt, hvor makulært ødem blev diagnosticeret. Nogle patienter havde forbedring i deres makulære ødemer efter seponering af deres thiazolidinedion. Patienter med diabetes skal have regelmæssige øjeundersøgelser af en øjenlæge i henhold til standarderne for pleje af American Diabetes Association. Derudover skal enhver diabetiker, der rapporterer nogen form for visuelt symptom, straks henvises til en øjenlæge, uanset patientens underliggende medicin eller andre fysiske fund. [Se BIVIRKNINGER.]
brud
I en 4- til 6-årig komparativ undersøgelse (ADOPT) med glykæmisk kontrol med monoterapi hos narkotika-naive patienter for nylig diagnosticeret med type 2-diabetes mellitus, blev der observeret en øget forekomst af knoglebrud hos kvindelige patienter, der tog AVANDIA. I perioden 4-6 år var forekomsten af knoglefraktur hos kvinder 9,3% (60/645) for AVANDIA mod 3,5% (21/605) for glyburid og 5,1% (30/590) for metformin. Denne øgede forekomst blev noteret efter det første behandlingsår og varede i løbet af studiet. Størstedelen af brud hos kvinder, der modtog AVANDIA, forekom i overarmen, hånden og foden. Disse brudpunkter er forskellige fra dem, der sædvanligvis er forbundet med postmenopausal osteoporose (for eksempel hofte eller rygsøjle). Der blev ikke observeret nogen stigning i brudhastigheder hos mænd behandlet med AVANDIA. Risikoen for brud bør overvejes ved pleje af patienter, især kvindelige patienter, der er behandlet med AVANDIA, og opmærksomhed rettet mod vurdering og opretholdelse af knoglesundhed i henhold til de nuværende standarder for omsorg.
Hæmatologiske effekter
Fald i gennemsnitligt hæmoglobin og hæmatokrit forekom på en dosisrelateret måde hos voksne patienter behandlet med AVANDIA [se BIVIRKNINGER]. De observerede ændringer kan være relateret til det øgede plasmavolumen, der er observeret ved behandling med AVANDIA.
Diabetes og blodsukkerkontrol
Patienter, der får AVANDIA i kombination med andre hypoglykæmiske midler, kan være i risiko for hypoglykæmi, og en reduktion i dosis af det samtidige middel kan være nødvendigt.
Periodisk fastende blodsukkermåling og HbA1c-målinger skal udføres for at overvåge terapeutisk respons.
Ægløsning
Terapi med AVANDIA, ligesom andre thiazolidinedioner, kan resultere i ægløsning hos nogle præmenopausale anovulatoriske kvinder. Som et resultat kan disse patienter have en øget risiko for graviditet, mens de tager AVANDIA [se Brug i specifikke befolkninger]. Derfor bør der anbefales tilstrækkelig antikonception hos kvinder, der er præmenopausale. Denne mulige effekt er ikke undersøgt specifikt i kliniske studier; derfor er hyppigheden af denne forekomst ikke kendt.
Selvom hormonel ubalance er set i prækliniske studier [se Ikke-klinisk toksikologi], er den kliniske betydning af dette fund ikke kendt. Hvis der opstår uventet menstruationsdysfunktion, bør fordelene ved fortsat behandling med AVANDIA gennemgås.
top
Bivirkninger
Klinisk forsøgsoplevelse
Voksen
I kliniske forsøg er ca. 9.900 patienter med type 2-diabetes behandlet med AVANDIA.
Kortvarige forsøg med AVANDIA som monoterapi og i kombination med andre hypoglykæmiske midler
Forekomsten og typer bivirkninger rapporteret i kortvarige kliniske forsøg med AVANDIA som monoterapi er vist i tabel 4.
Tabel 4 Bivirkninger (â € 5% i en hvilken som helst behandlingsgruppe) Rapporteret af patienter i kortvarige * Dobbeltblinde kliniske forsøg med AVANDIA som monoterapi
| Foretrukket periode | AVANDIA monoterapi N = 2.526 % |
Placebo N = 601 % |
Metformin N = 225 % |
Sulfonylureasâ € N = 626 % |
| Øvre luftvejsinfektion | 9.9 | 8.7 | 8.9 | 7.3 |
| Skade | 7.6 | 4.3 | 7.6 | 6.1 |
| Hovedpine | 5.9 | 5.0 | 8.9 | 5.4 |
| Rygsmerte | 4.0 | 3.8 | 4.0 | 5.0 |
| hyperglykæmi | 3.9 | 5.7 | 4.4 | 8.1 |
| Træthed | 3.6 | 5.0 | 4.0 | 1.9 |
| Bihulebetændelse | 3.2 | 4.5 | 5.3 | 3.0 |
| Diarré | 2.3 | 3.3 | 15.6 | 3.0 |
| hypoglykæmi | 0.6 | 0.2 | 1.3 | 5.9 |
|
* Kortvarige forsøg varierede fra 8 uger til 1 år. †Inkluderer patienter, der får glyburid (N = 514), gliclazid (N = 91) eller glipizid (N = 21). |
Generelt rapporteres typer bivirkninger uden hensyntagen til årsagssammenhæng, da AVANDIA blev brugt i kombination med en sulfonylurinstof eller metformin lignede dem under monoterapi med AVANDIA.
Begivenheder med anæmi og ødemer havde en tendens til at rapporteres hyppigere ved højere doser og var generelt milde til moderate i sværhedsgrad og krævede normalt ikke seponering af behandlingen med AVANDIA.
I dobbeltblinde studier blev anæmi rapporteret hos 1,9% af patienterne, der fik AVANDIA som monoterapi sammenlignet med 0,7% på placebo, 0,6% på sulfonylurinstoffer og 2,2% på metformin. Rapporter om anæmi var større hos patienter behandlet med en kombination af AVANDIA og metformin (7,1%) og med en kombination af AVANDIA og en sulfonylurinstof plus metformin (6,7%) sammenlignet med monoterapi med AVANDIA eller i kombination med en sulfonylurinstof (2.3%). Lavere niveauer af hæmoglobin / hæmatokrit hos patienter, der er registreret i de kliniske forsøg med metformin-kombination, kan have bidraget til den højere rapporteringshastighed for anæmi i disse undersøgelser [se BIVIRKNINGER].
I kliniske forsøg blev ødemer rapporteret hos 4,8% af patienterne, der fik AVANDIA som monoterapi sammenlignet med 1,3% på placebo, 1,0% på sulfonylurinstoffer og 2,2% på metformin. Rapporteringshastigheden for ødem var højere for AVANDIA 8 mg i sulfonylurinstof-kombinationer (12,4%) sammenlignet med andre kombinationer, med undtagelse af insulin. Ødem blev rapporteret hos 14,7% af patienterne, der fik AVANDIA i insulinkombinationstestene sammenlignet med 5,4% på insulin alene. Rapporter om ny begyndelse eller forværring af kongestiv hjertesvigt forekom med 1% for insulin alene og 2% (4 mg) og 3% (8 mg) for insulin i kombination med AVANDIA [se BOKSET ADVARSEL og ADVARSLER OG FORHOLDSREGLER].
I kontrollerede kombinationsbehandlingsundersøgelser med sulfonylurinstoffer blev der rapporteret milde til moderate hypoglykæmiske symptomer, som ser ud til at være dosisrelaterede. Få patienter blev trukket tilbage for hypoglykæmi (<1%), og få episoder med hypoglykæmi blev betragtet som alvorlige (<1%). Hypoglykæmi var den hyppigst rapporterede bivirkning i de faste kombinationsforsøg med insulin, skønt få patienter trak sig tilbage for hypoglykæmi (4 af 408 for AVANDIA plus insulin og 1 ud af 203 for insulin alene). Priserne for hypoglykæmi, bekræftet ved kapillær blodglukosekoncentration - ¤ ¤ 50 mg / dL, var 6% for insulin alene og 12% (4 mg) og 14% (8 mg) for insulin i kombination med AVANDIA. [Se ADVARSLER OG FORHOLDSREGLER.]
Langtidsforsøg med AVANDIA som monoterapi
En 4- til 6-årig undersøgelse (ADOPT) sammenlignede brugen af AVANDIA (n = 1.456), glyburid (n = 1.441) og metformin (n = 1.454) som monoterapi hos patienter, der for nylig blev diagnosticeret med type 2-diabetes, som ikke tidligere blev behandlet med antidiabetika medicinering. Tabel 5 viser bivirkninger uden hensyntagen til kausalitet; satser udtrykkes pr. 100 patientår (PY) -eksponering for at tage højde for forskellene i eksponering for studiemedicin i de 3 behandlingsgrupper.
I ADOPT blev der rapporteret frakturer hos et større antal kvinder behandlet med AVANDIA (9,3%, 2,7 / 100 patientår) sammenlignet med glyburid (3,5%, 1,3 / 100 patientår) eller metformin (5,1%, 1,5 / 100 patient-år).
Størstedelen af brud hos kvinder, der modtog rosiglitazon, blev rapporteret i overarmen, hånden og foden. [Se ADVARSLER OG FORHOLDSREGLER.] Den observerede forekomst af brud hos mandlige patienter var den samme blandt de 3 behandlingsgrupper.
Tabel 5 Bivirkninger ved terapi (â € ¥ 5 begivenheder / 100 patientår [PY]) i enhver behandlingsgruppe rapporteret i en 4- til 6-årig klinisk forsøg med AVANDIA som monoterapi (ADOPT)
| AVANDIA N = 1,456 PY = 4.954 |
Glyburide N = 1.441 PY = 4,244 |
Metformin N = 1,454 PY = 4.906 |
|
| nasopharyngitis | 6.3 | 6.9 | 6.6 |
| Rygsmerte | 5.1 | 4.9 | 5.3 |
| ledsmerter | 5.0 | 4.8 | 4.2 |
| Forhøjet blodtryk | 4.4 | 6.0 | 6.1 |
| Øvre luftvejsinfektion | 4.3 | 5.0 | 4.7 |
| hypoglykæmi | 2.9 | 13.0 | 3.4 |
| Diarré | 2.5 | 3.2 | 6.8 |
Pædiatrisk
Avandia er evalueret for sikkerhed i et enkelt, aktivt kontrolleret forsøg med pædiatriske patienter med type 2-diabetes, hvor 99 blev behandlet med Avandia og 101 blev behandlet med metformin. De mest almindelige bivirkninger (> 10%) uden hensyntagen til årsagssammenhæng for hverken Avandia eller metformin var hovedpine (17% versus 14%), kvalme (4% versus 11%), nasopharyngitis (3% versus 12%) og diarré (1% versus 13%). I denne undersøgelse blev der rapporteret et tilfælde af diabetisk ketoacidose i metformingruppen. Derudover var der 3 patienter i rosiglitazon-gruppen, der havde FPG på â300 mg / dL, 2+ ketonuri og et forhøjet aniongap.
Laboratorie abnormiteter
hæmatologiske
Fald i gennemsnitligt hæmoglobin og hæmatokrit forekom på en dosisrelateret måde hos voksne patienter, der blev behandlet med Avandia (gennemsnitligt fald i individuelle studier så meget som 1,0 g / dL hæmoglobin og så meget som 3,3% hæmatokrit). Ændringerne forekom primært i løbet af de første 3 måneder efter påbegyndelse af behandling med Avandia eller efter en dosisforøgelse i Avandia. Tidsforløbet og størrelsesordenen for fald var lignende hos patienter, der blev behandlet med en kombination af Avandia og andre hypoglykæmiske midler eller monoterapi med Avandia. Forbehandlingsniveauer af hæmoglobin og hæmatokrit var lavere hos patienter i metforminkombinationsundersøgelser og kan have bidraget til den højere rapporteringshastighed for anæmi. I en enkelt undersøgelse hos pædiatriske patienter rapporteredes fald i hæmoglobin og hæmatokrit (gennemsnitlige fald på henholdsvis 0,29 g / dL og 0,95%). Der er også rapporteret om små fald i hæmoglobin og hæmatokrit hos pædiatriske patienter behandlet med Avandia. Antallet af hvide blodlegemer faldt også lidt hos voksne patienter behandlet med Avandia. Fald i hæmatologiske parametre kan være relateret til øget plasmavolumen observeret ved behandling med Avandia.
Lipider
Ændringer i serumlipider er observeret efter behandling med Avandia hos voksne [se Klinisk farmakologi ]. Små ændringer i serumlipidparametre blev rapporteret hos børn behandlet med Avandia i 24 uger.
Serumtransaminase niveauer
I præ-godkendelses kliniske studier på 4.598 patienter behandlet med Avandia (3.600 patientår med eksponering) og i en langvarig 4- til 6-årigt studie på 1.456 patienter behandlet med Avandia (4.954 patientårs eksponering), var der ingen tegn på lægemiddelinduceret hepatotoksicitet.
I forudgående godkendte kontrollerede forsøg havde 0,2% af patienterne behandlet med Avandia forhøjelser i ALT> 3X den øvre normalgrænse sammenlignet med 0,2% for placebo og 0,5% på aktive komparatorer. ALT-forhøjelserne hos patienter behandlet med Avandia var reversible. Hyperbilirubinæmi blev fundet hos 0,3% af patienterne behandlet med Avandia sammenlignet med 0,9% behandlet med placebo og 1% hos patienter behandlet med aktive komparatorer. I kliniske forsøg med forudgående godkendelse var der ingen tilfælde af idiosynkratiske lægemiddelreaktioner, der førte til leversvigt. [Se Advarsler og forsigtighedsregler]
I det 4- til 6-årige ADOPT-forsøg behandlede patienter med Avandia (4.954 patientårs eksponering), glyburid (4.244 patientårs eksponering) eller metformin (4.906 patientårs eksponering), som monoterapi, havde den samme hastighed af ALT-stigning til> 3X øvre normalgrænse (0,3 pr. 100 patientår udsættelse).
Postmarketing-oplevelse
Ud over bivirkninger rapporteret fra kliniske forsøg er de nedenfor beskrevne hændelser identificeret under brug af Avandia efter godkendelse. Da disse begivenheder frivilligt rapporteres fra en population af ukendt størrelse, er det ikke muligt pålideligt at estimere deres hyppighed eller altid etablere et årsagsforhold til eksponering af medikamenter.
Hos patienter, der får thiazolidinedion-behandling, kan der være alvorlige bivirkninger med eller uden et dødeligt resultat relateret til volumenekspansion (fx congestiv hjertesvigt, lungemoder og pleurale effusioner) er rapporteret [se Boxed Advarsel og Advarsler og forsigtighedsregler].
Der er postmarketingrapporter med Avandia af hepatitis, forhøjet leverenzym til 3 eller flere gange øvre grænse for normal og leversvigt med og uden dødeligt resultat, skønt kausalitet ikke har været etableret.
Der er sjældent rapporteret om udslæt, kløe, urticaria, angioødem, anafylaktisk reaktion og Stevens-Johnson syndrom.
Der er også modtaget rapporter om ny debut eller forværring af diabetisk makulær ødem med nedsat synsskarphed [se Advarsler og forsigtighedsregler].
top
Lægemiddelinteraktioner
CYP2C8-hæmmere og induktorer
En hæmmer af CYP2C8 (f.eks. Gemfibrozil) kan forøge AUC for rosiglitazon, og en inducer af CYP2C8 (f.eks. Rifampin) kan nedsætte rosiglitazons AUC. Derfor, hvis en hæmmer eller en inducer af CYP2C8 startes eller stoppes under behandling med rosiglitazon, kan der være behov for ændringer i diabetesbehandling baseret på klinisk respons. [Se KLINISK FARMAKOLOGI.]
top
Brug i specifikke befolkninger
Graviditet
Graviditet kategori C.
Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andet negativt resultat, uanset eksponering af medicin. Denne baggrundsrisiko øges i graviditeter kompliceret af hyperglykæmi og kan reduceres med god metabolisk kontrol. Det er vigtigt for patienter med diabetes eller historie med svangerskabsdiabetes at opretholde en god metabolisk kontrol inden befrugtningen og under hele graviditeten. Omhyggelig overvågning af glukosekontrol er vigtig hos sådanne patienter. De fleste eksperter anbefaler, at man anvender insulinmonoterapi under graviditet for at opretholde blodsukkerniveauet så tæt på det normale som muligt.
Human data: Rosiglitazon er rapporteret at krydse den menneskelige morkage og bedetekteres i føtalvæv. Den kliniske betydning af disse fund er ukendt. Der er ingen tilstrækkelige og godt kontrollerede studier på gravide kvinder. AVANDIA bør ikke anvendes under graviditet.
Dyreforsøg: Der var ingen effekt på implantation eller embryoet med rosiglitazonbehandling under den tidlige graviditet hos rotter, men behandling under midten af sene drægtighed var forbundet med føtal død og væksthæmning hos både rotter og kaniner. Teratogenicitet blev ikke observeret i doser op til 3 mg / kg hos rotter og 100 mg / kg hos kaniner (henholdsvis ca. 20 og 75 gange human AUC ved den maksimale anbefalede humane daglige dosis). Rosiglitazon forårsagede placentapatologi hos rotter (3 mg / kg / dag). Behandling af rotter under drægtighed gennem amning reducerede kuldstørrelse, neonatal levedygtighed og postnatal vækst, med væksthæmning reversibel efter puberteten. For effekter på placenta, embryo / foster og afkom var dosis uden virkning 0,2 mg / kg / dag hos rotter og 15 mg / kg / dag hos kaniner. Disse niveauer uden virkning er ca. 4 gange human AUC ved den maksimale anbefalede daglige humane dosis. Rosiglitazone reducerede antallet af livmoderimplantationer og levende afkom, når juvenile hunrotter blev behandlet ved 40 mg / kg / dag fra 27 dages alder til seksuel modenhed (ca. 68 gange den humane AUC på det maksimale anbefalede dagligt dosis). Ingen effektniveau var 2 mg / kg / dag (ca. 4 gange human AUC ved den maksimale anbefalede daglige dosis). Der var ingen effekt på overlevelse eller vækst før og efter fødsel.
Arbejdskraft og levering
Virkningen af rosiglitazon på fødsel og levering hos mennesker er ikke kendt.
Sygeplejerske mødre
Lægemiddelrelateret materiale blev påvist i mælk fra ammende rotter. Det vides ikke, om AVANDIA udskilles i modermælk. Da mange lægemidler udskilles i modermælk, bør AVANDIA ikke administreres til en ammende kvinde.
Pædiatrisk brug
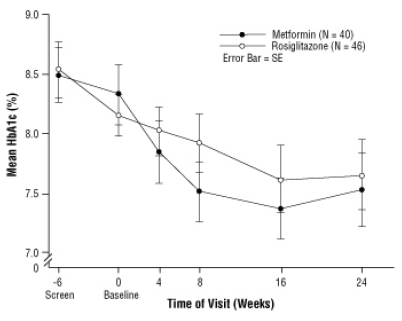
Efter placeboopkørsel inklusive diætrådgivning, børn med type 2 diabetes mellitus i alderen 10 til 17 år og med en gennemsnitlig kropsmasseindeks (BMI) på 33 kg / m, blev randomiseret til behandling med 2 mg to gange dagligt AVANDIA (n = 99) eller 500 mg to gange dagligt metformin (n = 101) i en 24-ugers, dobbeltblind klinisk forsøg. Som forventet faldt FPG hos patienter, der ikke var til diabetesmedicin (n = 104) og steg hos patienter, der blev trukket tilbage fra tidligere medicin (normalt metformin) (n = 90) i løbet af indkøringsperioden. Efter mindst 8 ugers behandling havde 49% af patienterne behandlet med AVANDIA og 55% af metforminbehandlede patienter deres dosis fordoblet, hvis FPG> 126 mg / dL. For den samlede population med forsigtighed til behandling var uge 24 den gennemsnitlige ændring fra baseline i HbA1c -0,14% med AVANDIA og -0,49% med metformin. Der var et utilstrækkeligt antal patienter i denne undersøgelse til statistisk at fastslå, om disse
observerede gennemsnitlige behandlingseffekter var ens eller forskellige. Behandlingseffekter adskiller sig fra patienter, der ikke var efter behandling med antidiabetika, og for patienter, der tidligere blev behandlet med antidiabetisk behandling (tabel 6).
Tabel 6 Uge 24 FPG- og HbA1c-ændring fra baseline Sidste observationsbåren fremad hos børn med baseline HbA1c> 6,5%
| Naïve patienter | Tidligere behandlede patienter | |||
|
Metformin N = 40 |
Rosiglitazon N = 45 |
Metformin N = 43 |
Rosiglitazon N = 32 |
|
| FPG (mg / dL) | ||||
| Baseline (gennemsnit) | 170 | 165 | 221 | 205 |
| Skift fra basislinje (gennemsnit) | -21 | -11 | -33 | -5 |
| Justeret behandlingsforskel * (rosiglitazon-metformin) - (95% CI) | 8 (-15, 30) |
21 (-9, 51) |
||
| % af patienterne med 30 mg / dL ¥ faldt fra baseline | 43% | 27% | 44% | 28% |
| HbA1c (%) | ||||
| Baseline (gennemsnit) | 8.3 | 8.2 | 8.8 | 8.5 |
| Skift fra basislinje (gennemsnit) | -0.7 | -0.5 | -0.4 | 0.1 |
| Justeret behandlingsforskel * (rosiglitazon-metformin) - (95% CI) | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| % af patienter med â € 0,7% falder fra baseline | 63% | 52% | 54% | 31% |
|
* Ændring fra baseline-midler er mindst firkanter betyder justering for basislinien HbA1c, køn og region. †Positive værdier for forskellen favoriserer metformin. |
Behandlingsforskelle var afhængige af baseline BMI eller vægt, således at virkningerne af AVANDIA og metformin syntes mere sammenlignelige blandt tungere patienter. Den medianvægtforøgelse var 2,8 kg med rosiglitazon og 0,2 kg med metformin [se ADVARSLER OG FORHOLDSREGLER]. Fireogtyve procent af patienterne behandlet med rosiglitazon og 32% af patienterne behandlet med metformin fik â 2 kg, og 33% af patienterne behandlet med rosiglitazon og 7% af patienterne behandlet med metformin fik â € 5 kg på undersøgelse.
Bivirkninger observeret i denne undersøgelse er beskrevet i bivirkninger).
Figur 3 Gennemsnitlig HbA1c over tid i en 24-ugers undersøgelse af AVANDIA og Metformin hos pædiatriske patienter - Drug-Naïve undergruppe
Geriatrisk brug
Resultater af populationsfarmakokinetisk analyse viste, at alder ikke signifikant påvirker farmakokinetikken for rosiglitazon [se KLINISK FARMAKOLOGI]. Derfor kræves der ingen dosisjusteringer til ældre. I kontrollerede kliniske forsøg blev der ikke observeret nogen generelle forskelle i sikkerhed og effektivitet mellem ældre (â € 65 år) og yngre (<65 år) patienter.
top
overdosering
Der findes begrænsede data med hensyn til overdosering hos mennesker. I kliniske studier på frivillige er AVANDIA blevet administreret i enkelte orale doser på op til 20 mg og var godt tolereret. I tilfælde af overdosering skal passende understøttende behandling påbegyndes som dikteret af patientens kliniske status.
top
Beskrivelse
AVANDIA (rosiglitazon maleat) er et oralt antidiabetisk middel, der primært virker ved at øge insulinfølsomheden. AVANDIA forbedrer den glykæmiske kontrol, mens den reducerer cirkulerende insulinniveauer.
Rosiglitazonmaleat er ikke kemisk eller funktionelt relateret til sulfonylurinstofferne, biguaniderne eller alfa-glucosidaseinhibitorerne.
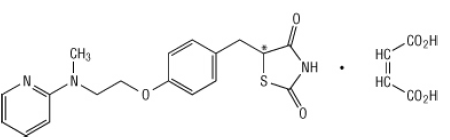
Kemisk er rosiglitazonmaleat (±) -5 - [[4- [2- (methyl-2-pyridinylamino) ethoxy] phenyl] methyl] -2,4-thiazolidinedion, (Z) -2-butenedioat (1: 1) med en molekylvægt på 473,52 (357,44 fri base). Molekylet har et enkelt chiralt center og er til stede som et racemat. På grund af hurtig interkonversion kan enantiomererne funktionelt ikke skelnes. Den strukturelle formel for rosiglitazonmaleat er:
Molekylformlen er C18H19N3O3S-C4H4O4. Rosiglitazon maleat er et hvidt til off-white fast stof med et smeltepunktinterval fra 122 til 123 ° C. PKa-værdierne for rosiglitazonmaleat er 6,8 og 6,1. Det er let opløseligt i ethanol og a bufret vandig opløsning med en pH-værdi på 2,3; opløselighed falder med stigende pH i det fysiologiske rækkevidde.
Hver femkantede filmovertrukne TILTAB-tablet indeholder rosiglitazonmaleat svarende til rosiglitazon, 2 mg, 4 mg eller 8 mg, til oral administration. Inaktive ingredienser er: Hypromellose 2910, lactosemonohydrat, magnesiumstearat, mikrokrystallinsk cellulose, polyethylenglycol 3000, natriumstivelsesglykolat, titandioxid, triacetin og 1 eller flere af følgende: Syntetiske røde og gule jernoxider og talkum.
top
Klinisk farmakologi
Handlingsmekanisme
Rosiglitazone, et medlem af thiazolidinedion-klassen af antidiabetika, forbedrer den glykæmiske kontrol ved at forbedre insulinfølsomheden. Rosiglitazone er en meget selektiv og potent agonist til den peroxisomproliferator-aktiverede receptor-gamma (PPARγ). Hos mennesker findes PPAR-receptorer i centrale målvæv til insulinvirkning, såsom fedtvæv, skeletmuskel og lever. Aktivering af PPARγ nukleare receptorer regulerer transkriptionen af insulin-responsive gener involveret i kontrollen af glukoseproduktion, transport og anvendelse. Derudover deltager PPARγ-responsive gener også i reguleringen af fedtsyremetabolismen.
Insulinresistens er et almindeligt træk, der kendetegner patogenesen af type 2-diabetes. Den antidiabetiske aktivitet af rosiglitazon er påvist i dyremodeller af type 2-diabetes i hvilken hyperglykæmi og / eller nedsat glukosetolerance er en konsekvens af insulinresistens i målet væv. Rosiglitazone reducerer blodglukosekoncentrationerne og reducerer hyperinsulinæmi hos obese / obese obese mus, db / db diabetisk mus og fa / fa fedt Zucker rotte.
I dyremodeller blev den antidiabetiske aktivitet af rosiglitazon vist at være formidlet af øget følsomhed over for insulinens virkning i lever-, muskel- og fedtvæv. Farmakologiske undersøgelser i dyremodeller indikerer, at rosiglitazon hæmmer glukoneogenese i leveren. Ekspressionen af den insulinregulerede glukosetransportør GLUT-4 blev forøget i fedtvæv. Rosiglitazon inducerede ikke hypoglykæmi i dyremodeller af type 2-diabetes og / eller nedsat glukosetolerance.
farmakodynamik
Patienter med lipid abnormaliteter blev ikke udelukket fra kliniske forsøg med AVANDIA.
I alle 26-ugers kontrollerede forsøg, i det anbefalede dosisområde, var AVANDIA som monoterapi forbundet med stigninger i total kolesterol, LDL og HDL og fald i frie fedtsyrer. Disse ændringer var statistisk signifikant forskellige fra placebo- eller glyburidkontroller (tabel 7).
Stigninger i LDL forekom primært i løbet af de første 1 til 2 måneder af behandling med AVANDIA, og LDL-niveauer forblev forhøjede over basislinien gennem alle forsøgene. I modsætning hertil fortsatte HDL med at stige over tid. Som et resultat toppede LDL / HDL-forholdet sig efter 2 måneders behandling og så ud til at falde over tid. På grund af den tidsmæssige karakter af lipidændringer er den 52-ugers glyburid-kontrollerede undersøgelse mest relevant for at vurdere langtidsvirkninger på lipider. Ved baseline, uge 26 og uge 52, var gennemsnitlige LDL / HDL-forhold henholdsvis 3,1, 3,2 og 3,0 for AVANDIA 4 mg to gange dagligt. De tilsvarende værdier for glyburid var 3,2, 3,1 og 2,9. Forskellene i ændring fra baseline mellem AVANDIA og glyburid i uge 52 var statistisk signifikante.
Mønsteret af LDL- og HDL-ændringer efter behandling med AVANDIA i kombination med andre hypoglykæmiske midler var generelt de samme som dem, der blev set med AVANDIA i monoterapi.
Ændringerne i triglycerider under terapi med AVANDIA var varierende og var generelt ikke statistisk forskellige fra placebo- eller glyburidkontroller.
Tabel 7 Resumé af gennemsnitlige lipidændringer i 26-ugers placebokontrolleret og 52-ugers gliburid-kontrolleret monoterapiundersøgelser
| Placebo-kontrollerede studier uge 26 | Glyburid-kontrolleret undersøgelsesuge 26 og uge 52 | ||||||
| Placebo | AVANDIA | Glyburide titrering | AVANDIA 8 mg | ||||
| 4 mg dagligt * | 8 mg dagligt * | Wk 26 | Wk 52 | Wk 26 | Wk 52 | ||
| Frie fedtsyrer | |||||||
| N | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| Baseline (gennemsnit)% | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| Skift fra basislinje (gennemsnit) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| LDL | |||||||
| N | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| Baseline (gennemsnit)% | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| Skift fra basislinje (gennemsnit) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| HDL | |||||||
| N | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| Baseline (gennemsnit)% | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| Skift fra basislinje (gennemsnit) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * En gang dagligt og to gange dagligt blev doseringsgrupper kombineret. |
Farmakokinetik
Maksimal plasmakoncentration (Cmax) og arealet under kurven (AUC) af rosiglitazon stiger på en dosisforholdsmæssig måde over det terapeutiske dosisområde (tabel 8). Eliminationshalveringstiden er 3 til 4 timer og er uafhængig af dosis.
Tabel 8 Gennemsnitlige (SD) farmakokinetiske parametre for rosiglitazon efter enkelte orale doser (N = 32)
| Parameter | 1 mg faste | 2 mg faste | 8 mg faste | 8 mg Fed |
| AUC0-inf [Ng-time / ml] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Cmax [Ng / ml] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| Halvt liv [Hr] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| CL / F * [L / time] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * CL / F = Oral clearance. |
absorption
Den absolutte biotilgængelighed af rosiglitazon er 99%. Højeste plasmakoncentration observeres ca. 1 time efter dosering. Indgivelse af rosiglitazon sammen med mad resulterede ikke i nogen ændring i den samlede eksponering (AUC), men der var et ca. 28% fald i Cmax og en forsinkelse i Tmax (1,75 timer). Disse ændringer er sandsynligvis ikke klinisk signifikante; derfor kan AVANDIA administreres med eller uden mad.
Fordeling
Det gennemsnitlige (CV%) orale distributionsvolumen (Vss / F) af rosiglitazon er ca. 17,6 (30%) liter, baseret på en populationsfarmakokinetisk analyse. Rosiglitazone er ca. 99,8% bundet til plasmaproteiner, primært albumin.
Metabolisme
Rosiglitazone metaboliseres i vid udstrækning uden at noget uændret lægemiddel udskilles i urinen. De vigtigste metaboliseringsveje var N-demethylering og hydroxylering efterfulgt af konjugering med sulfat og glucuronsyre. Alle de cirkulerende metabolitter er betydeligt mindre potente end forældrene og forventes derfor ikke at bidrage til den insulinfølsomhedsmæssige aktivitet af rosiglitazon.
In vitro-data viser, at rosiglitazon overvejende metaboliseres af Cytochrome P450 (CYP) isoenzym 2C8, hvor CYP2C9 bidrager som en mindre vej.
udskillelse
Efter oral eller intravenøs indgivelse af [14C] rosiglitazonmaleat blev ca. 64% og 23% af dosis elimineret i henholdsvis urinen og i fæces. Plasmahalveringstiden for [14C] -relateret materiale varierede fra 103 til 158 timer.
Befolkningsfarmakokinetik hos patienter med type 2-diabetes
Befolkningsfarmakokinetiske analyser fra 3 store kliniske forsøg, herunder 642 mænd og 405 kvinder med type 2-diabetes (35 år) til 80 år) viste, at rosiglitazons farmakokinetik ikke er påvirket af alder, race, rygning eller alkohol forbrug. Både oral clearance (CL / F) og oral steady-state distributionsvolumen (Vss / F) viste sig at stige med stigning i kropsvægt. Over det vægtområde, der blev observeret i disse analyser (50 til 150 kg), varierede området for forudsagte CL / F- og Vss / F-værdier henholdsvis <1,7 gange og <2,3 gange.
Derudover blev rosiglitazon CL / F vist at være påvirket af både vægt og køn, idet den var lavere (ca. 15%) hos kvindelige patienter.
Særlige befolkninger
Geriatrisk
Resultater af den farmakokinetiske populationsanalyse (n = 716 <65 år; n = 331 â € 65 år) viste, at alder ikke påvirker farmakokinetikken af rosiglitazon signifikant.
Køn
Resultaterne af populationsfarmakokinetikanalysen viste, at den gennemsnitlige orale clearance af rosiglitazon i kvindelige patienter (n = 405) var ca. 6% lavere sammenlignet med mandlige patienter med den samme kropsvægt (n = 642).
Som monoterapi og i kombination med metformin forbedrede AVANDIA den glykæmiske kontrol hos både mænd og kvinder. I metformin-kombinationsundersøgelser blev effektiviteten påvist uden kønsforskelle i glykæmisk respons.
I monoterapistudier blev der observeret en større terapeutisk respons hos kvinder; hos mere overvægtige patienter var kønsmæssige forskelle imidlertid mindre tydelige. For et givet kropsmasseindeks (BMI) har kvinder en tendens til at have en større fedtmasse end mænd. Da det molekylære mål PPARγ udtrykkes i fedtvæv, kan denne differentierende karakteristik, i det mindste delvist, forklare den større respons på AVANDIA hos kvinder. Da behandlingen skal individualiseres, er det ikke nødvendigt at justere dosis baseret på køn alene.
Nedsat leverfunktion
Ubundet oral clearance af rosiglitazon var signifikant lavere hos patienter med moderat til svær leversygdom (Child-Pugh klasse B / C) sammenlignet med raske forsøgspersoner. Som et resultat blev ubundet Cmax og AUC0-inf forøget henholdsvis 2- og 3 gange. Eliminationshalveringstiden for rosiglitazon var ca. 2 timer længere hos patienter med leversygdom sammenlignet med raske forsøgspersoner.
Behandling med AVANDIA bør ikke påbegyndes, hvis patienten udviser klinisk bevis for, at den er aktiv leversygdom eller forhøjede serumtransaminasniveauer (ALT> 2,5X øvre normalgrænse) ved baseline [se ADVARSLER OG FORHOLDSREGLER].
Pædiatrisk
Farmakokinetiske parametre for rosiglitazon hos pædiatriske patienter blev fastlagt ved hjælp af en populationsfarmakokinetisk analyse med sparsomme data fra 96 pædiatriske patienter i et enkelt klinisk pædiatrisk forsøg, herunder 33 mænd og 63 kvinder med alderen fra 10 til 17 år (vægt fra 35 til 178,3 kg). Befolkningens gennemsnitlige CL / F og V / F for rosiglitazon var henholdsvis 3,15 L / time og 13,5 L. Disse estimater af CL / F og V / F var i overensstemmelse med de typiske parameterestimater fra en tidligere voksent populationsanalyse.
Nedsat nyrefunktion
Der er ingen klinisk relevante forskelle i farmakokinetikken af rosiglitazon hos patienter med let til alvorlig nedsat nyrefunktion eller hos hæmodialyseafhængige patienter sammenlignet med personer med normalt nyre fungere. Dosisjustering er derfor ikke nødvendig hos sådanne patienter, der får AVANDIA. Da metformin er kontraindiceret til patienter med nedsat nyrefunktion, er samtidig administration af metformin med AVANDIA kontraindiceret til disse patienter.
Race
Resultater af en farmakokinetisk populationsanalyse inklusive individer med kaukasisk, sort og anden etnisk oprindelse indikerer, at race ikke har nogen indflydelse på rosiglitazons farmakokinetik.
Drug-Drug Interactions
Lægemidler, der hæmmer, inducerer eller metaboliseres af Cytochrome P450
In vitro-undersøgelser af lægemiddelmetabolisme antyder, at rosiglitazon ikke hæmmer nogen af de største P450-enzymer i klinisk relevante koncentrationer. In vitro-data viser, at rosiglitazon overvejende metaboliseres af CYP2C8 og i mindre grad 2C9. Det viste sig, at AVANDIA (4 mg to gange dagligt) ikke havde nogen klinisk relevant effekt på farmakokinetikken af nifedipin og orale prævention (ethinyløstradiol og norethindrone), der overvejende metaboliseres af CYP3A4.
gemfibrozil
Samtidig administration af gemfibrozil (600 mg to gange dagligt), en hæmmer af CYP2C8 og rosiglitazon (4 mg en gang dagligt) i 7 dage steg AUC for rosiglitazon med 127% sammenlignet med indgivelsen af rosiglitazon (4 mg en gang dagligt) alene. I betragtning af potentialet for dosisrelaterede bivirkninger med rosiglitazon kan der være behov for et fald i dosis af rosiglitazon, når gemfibrozil introduceres [se Drugsinteraktioner].
rifampin
Indgivelse af Rifampin (600 mg en gang dagligt), en inducerende CYP2C8 i 6 dage, rapporteres at reducere AUC for rosiglitazon med 66% sammenlignet med indgivelse af rosiglitazon (8 mg) alene [se Drugsinteraktioner].4
Glyburide
AVANDIA (2 mg to gange dagligt) taget samtidigt med glyburid (3,75 til 10 mg / dag) i 7 dage ændrede ikke de gennemsnitlige steady-state 24-timers plasmaglucosekoncentrationer hos diabetespatienter stabiliserede sig på glyburid terapi. Gentagne doser af AVANDIA (8 mg en gang dagligt) i 8 dage hos raske voksne kaukasiske forsøgspersoner forårsagede et fald i AUC og Cmax på ca. 30%. Hos japanske forsøgspersoner steg AUC og Cmax for glyburid lidt efter samtidig administration af AVANDIA.
glimepirid
Enkelt orale doser af glimepirid hos 14 raske voksne forsøgspersoner havde ingen klinisk signifikant effekt på farmakokinetikken ved AVANDIA ved stabil tilstand. Ingen klinisk signifikante reduktioner i AUC og C for glimepiridmax blev observeret efter gentagne doser AVANDIA (8 mg en gang dagligt) i 8 dage hos raske voksne personer.
Metformin
Samtidig administration af AVANDIA (2 mg to gange dagligt) og metformin (500 mg to gange dagligt) hos sundt frivillige i 4 dage havde ingen indflydelse på farmakokinetikken ved stabil tilstand af hverken metformin eller rosiglitazon.
Acarbose
Samtidig administration af acarbose (100 mg tre gange dagligt) i 7 dage hos raske frivillige havde ingen klinisk relevant effekt på farmakokinetikken af en enkelt oral dosis AVANDIA.
Digoxin
Gentagen oral dosering af AVANDIA (8 mg en gang dagligt) i 14 dage ændrede ikke den jævne farmakokinetik af digoxin (0,375 mg en gang dagligt) hos raske frivillige.
Warfarin
Gentagen dosering med AVANDIA havde ingen klinisk relevant effekt på farmakokinetikken ved warfarin-enantiomerer ved stabil tilstand.
ethanol
En enkelt indgivelse af en moderat mængde alkohol forøgede ikke risikoen for akut hypoglykæmi hos type 2-diabetes mellitus-patienter behandlet med AVANDIA.
Ranitidine
Forbehandling med ranitidin (150 mg to gange dagligt i 4 dage) ændrede ikke farmakokinetikken for hver enkelt orale eller intravenøse doser af rosiglitazon hos raske frivillige.
Disse resultater antyder, at absorptionen af oral rosiglitazon ikke ændres under betingelser ledsaget af stigning i gastrointestinal pH.
top
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, forringelse af fertilitet
carcinogenese:
En 2-årig carcinogenicitetsundersøgelse blev udført i Charles River CD-1-mus i doser på 0,4, 1,5 og 6 mg / kg / dag i kosten (højeste dosis svarende til ca. 12 gange human AUC ved det maksimale anbefalede menneske dagligt dosis). Sprague-Dawley-rotter blev doseret i 2 år ved oral dosering i doser på 0,05, 0,3 og 2 mg / kg / dag (højeste dosisækvivalent til ca. 10 og 20 gange human AUC ved den maksimale anbefalede daglige humane dosis for han- og hunrotter, henholdsvis).
Rosiglitazon var ikke kræftfremkaldende i musen. Der var en stigning i forekomsten af fedt-hyperplasi hos musen i doser 1,5 mg / kg / dag (ca. 2 gange human AUC ved den maksimale anbefalede humane daglige dosis). Hos rotter var der en signifikant stigning i forekomsten af godartede fedtvævetumorer (lipomer) i doser 0,3 mg / kg / dag (ca. 2 gange human AUC ved den maksimale anbefalede daglige humane dosis). Disse proliferative ændringer i begge arter betragtes på grund af den vedvarende farmakologiske overstimulering af fedtvæv.
mutagenese:
Rosiglitazon var ikke mutagent eller klastogent i in vitro-bakterieanalyserne for genmutation, in vitro kromosomafvigelsestest i humane lymfocytter, in vivo-musmikronukleustest og in vivo / in vitro-rotte UDS assay. Der var en lille (ca. 2 gange) stigning i mutation i in vitro-muselymfomeassay i nærvær af metabolisk aktivering.
Nedskrivning af fertilitet:
Rosiglitazone havde ingen effekter på parring eller fertilitet af hanrotter givet op til 40 mg / kg / dag (ca. 116 gange human AUC ved den maksimale anbefalede daglige humane dosis). Rosiglitazon ændrede estrocyclicitet (2 mg / kg / dag) og reducerede fertilitet (40 mg / kg / dag) af hunrotter i forbindelse med lavere plasmaniveauer af progesteron og østradiol (ca. 20 og 200 gange human AUC ved den maksimale anbefalede humane daglige dosis, henholdsvis). Ingen sådanne effekter blev observeret ved 0,2 mg / kg / dag (ca. 3 gange human AUC ved den maksimale anbefalede humane daglige dosis). Hos unge rotter, der blev doseret fra 27 dages alder til seksuel modenhed (ved op til 40 mg / kg / dag), var der ingen effekt på den mandlige reproduktionsevne, eller på estrocyclicitet, parringsevne eller graviditetsforekomst hos kvinder (ca. 68 gange AUC ved det maksimale anbefalede menneske dagligt) dosis). Hos aber blev rosiglitazon (0,6 og 4,6 mg / kg / dag; ca. 3 og 15 gange human AUC ved henholdsvis den maksimale anbefalede humane daglige dosis) formindskede follikelfasestigningen i serumøstradiol med efterfølgende reduktion i bølgen i luteiniserende hormon, lavere progesteronniveauer i lutealfasen og amenorré. Mekanismen for disse effekter ser ud til at være direkte hæmning af ovarie-steroidogenese.
Dyretoksikologi
Hjertevægte blev øget hos mus (3 mg / kg / dag), rotter (5 mg / kg / dag) og hunde (2 mg / kg / dag) med rosiglitazon behandlinger (ca. 5, 22 og 2 gange human AUC i henholdsvis den maksimale anbefalede humane daglige dosis). Effekter hos unge rotter var i overensstemmelse med dem, der blev set hos voksne. Morfometrisk måling indikerede, at der var hypertrofi i hjerteventrikulære væv, hvilket kan skyldes øget hjertearbejde som et resultat af plasmavolumenudvidelse.
top
Kliniske studier
monoterapi
I kliniske studier resulterede behandling med AVANDIA i en forbedring i glykæmisk kontrol, målt ved FPG og HbA1c, med en samtidig reduktion i insulin og C-peptid. Postprandial glukose og insulin blev også reduceret. Dette stemmer overens med AVANDIA's virkningsmekanisme som insulinfølsomhed.
Den maksimale anbefalede daglige dosis er 8 mg. Dosis varierende undersøgelser antydede, at der ikke blev opnået nogen yderligere fordel med en samlet daglig dosis på 12 mg.
Kortvarige kliniske studier: I alt 2.315 patienter med type 2-diabetes, tidligere behandlet med diæt alene eller antidiabetika (r), blev behandlet med AVANDIA som monoterapi i 6 dobbeltblinde undersøgelser, der omfattede to 26-ugers placebokontrollerede studier, en 52-ugers glyburid-kontrolleret undersøgelse og 3 placebokontrollerede dosisregulerende undersøgelser med en varighed på 8 til 12 uger. Tidligere (e) antidiabetika (r) blev trukket tilbage, og patienter indgik en 2- til 4 ugers placebo-run-in periode før randomisering.
To 26-ugers, dobbeltblinde, placebokontrollerede forsøg hos patienter med type 2-diabetes (n = 1.401) med utilstrækkelig glykæmisk kontrol (gennemsnitlig basislinje FPG ca. 228 mg / dL [101 til 425 mg / dL] og gennemsnitlig basislinje HbA1c 8,9% [5,2% til 16,2%]), var gennemført. Behandling med AVANDIA producerede statistisk signifikante forbedringer i FPG og HbA1c sammenlignet med baseline og i forhold til placebo. Data fra en af disse undersøgelser er sammenfattet i tabel 9.
Tabel 9: Glykæmiske parametre i et 26-ugers placebokontrolleret forsøg
| Placebo N = 173 |
AVANDIA | AVANDIA | |||
| 4 mg en gang dagligt N = 180 |
2 mg to gange dagligt N = 186 |
8 mg en gang dagligt N = 181 |
4 mg to gange dagligt N = 187 |
||
| FPG (mg / dL) | |||||
| Baseline (gennemsnit) | 225 | 229 | 225 | 228 | 228 |
| Skift fra basislinje (gennemsnit) | 8 | -25 | -35 | -42 | -55 |
| Forskel fra placebo (justeret gennemsnit) | - | -31* | -43* | -49* | -62* |
| % af patienterne med 30 mg / dL ¥ faldt fra baseline | 19% | 45% | 54% | 58% | 70% |
| HbA1c (%) | |||||
| Baseline (gennemsnit) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| Skift fra basislinje (gennemsnit) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| Forskel fra placebo (justeret gennemsnit) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| % af patienter med â € 0,7% falder fra baseline | 9% | 28% | 29% | 39% | 54% |
| * p <0,0001 sammenlignet med placebo. |
Når administreret i den samme samlede daglige dosis, var AVANDIA generelt mere effektiv til at reducere FPG og HbA1c, når det blev administreret i opdelte doser to gange dagligt sammenlignet med en gang daglige doser. For HbA1c var forskellen mellem 4 mg en gang dagligt og 2 mg to gange dagligt dog ikke statistisk signifikant.
Langvarige kliniske studier
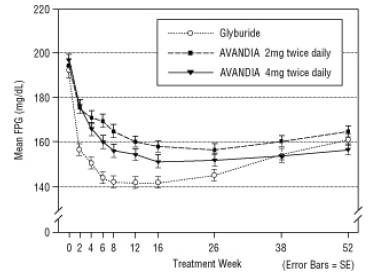
Langvarig opretholdelse af effekten blev evalueret i et 52-ugers dobbeltblindt, glyburid-kontrolleret forsøg hos patienter med type 2-diabetes. Patienterne blev randomiseret til behandling med AVANDIA 2 mg to gange dagligt (N = 195) eller AVANDIA 4 mg to gange dagligt (N = 189) eller glyburid (N = 202) i 52 uger. Patienter, der modtog glyburid, fik en initial dosis på enten 2,5 mg / dag eller 5,0 mg / dag. Doseringen blev derefter titreret i trin på 2,5 mg / dag i løbet af de næste 12 uger til en maksimal dosis på 15,0 mg / dag for at optimere den glykæmiske kontrol. Derefter blev glyburid-dosis konstant holdt.
Den median titrerede dosis af glyburid var 7,5 mg. Alle behandlinger resulterede i en statistisk signifikant forbedring af glykæmisk kontrol fra basislinjen (figur 4 og figur 5). Ved udgangen af uge 52 var reduktionen fra baseline i FPG og HbA1c -40,8 mg / dL og -0,53% med AVANDIA 4 mg to gange dagligt; -25,4 mg / dL og -0,27% med AVANDIA 2 mg to gange dagligt; og -30,0 mg / dL og -0,72% med glyburid. For HbA1c var forskellen mellem AVANDIA 4 mg to gange dagligt og glyburid ikke statistisk signifikant i uge 52. Det oprindelige fald i FPG med glyburid var større end med AVANDIA; denne virkning var dog mindre holdbar over tid.
Forbedringen i glykæmisk kontrol set med AVANDIA 4 mg to gange dagligt i uge 26 blev opretholdt gennem uge 52 af undersøgelsen.
Figur 4 Gennemsnitlig FPG over tid i en 52-ugers Glyburid-kontrolleret undersøgelse
Figur 5 Gennemsnitlig HbA1c over tid i en 52-ugers gliburidstyret undersøgelse

Hypoglycæmi blev rapporteret hos 12,1% af de glyburidbehandlede patienter mod 0,5% (2 mg to gange dagligt) og 1,6% (4 mg to gange dagligt) af patienter behandlet med AVANDIA. Forbedringerne i glykæmisk kontrol var forbundet med en gennemsnitlig vægtøgning på 1,75 kg og 2,95 kg for patienter behandlet med henholdsvis 2 mg og 4 mg to gange dagligt af AVANDIA mod 1,9 kg i glyburid-behandlet patienter. Hos patienter behandlet med AVANDIA var C-peptid, insulin, pro-insulin og pro-insulin opdelte produkter signifikant reduceret på en dosisordnet måde sammenlignet med en stigning i glyburid-behandlet patienter.
Et Diabetes Outcome Progression Trial (ADOPT) var et multicenter, dobbeltblindt, kontrolleret forsøg (N = 4.351) udført i løbet af 4 til 6 år for at sammenligne sikkerhed og effektivitet af AVANDIA, metformin og glyburid-monoterapi hos patienter, der for nylig er diagnosticeret med type 2-diabetes mellitus (â ‰ ¤ 3 år), som er utilstrækkeligt kontrolleret med diæt og dyrke motion. Middelalderen for patienter i dette forsøg var 57 år, og størstedelen af patienterne (83%) havde ingen kendt historie om hjerte-kar-sygdom. Den gennemsnitlige basislinje FPG og HbA1c var henholdsvis 152 mg / dL og 7,4%. Patienterne blev randomiseret til at modtage enten AVANDIA 4 mg en gang dagligt, glyburid 2,5 mg en gang dagligt eller metformin 500 mg en gang dagligt, og doserne blev titreret til optimal glykæmisk kontrol op til maksimalt 4 mg to gange dagligt for AVANDIA, 7,5 mg to gange dagligt for glyburid og 1.000 mg to gange dagligt for metformin. Det primære effektresultat var tid til sammenhængende FPG> 180 mg / dL efter mindst 6 ugers behandling maksimalt tolereret dosis af studiemedicin eller tid til utilstrækkelig glykæmisk kontrol, som bestemt af en uafhængig bedømmelse udvalg.
Den kumulative forekomst af det primære effektudbytte efter 5 år var 15% med AVANDIA, 21% med metformin og 34% med glyburid (fareforhold 0,68 [95% Cl 0,55, 0,85] versus metformin, HR 0,37 [95% Cl 0,30, 0,45] mod glyburid).
Data om kardiovaskulær og bivirkning (inklusive effekter på kropsvægt og knogelfraktur) fra ADOPT for AVANDIA, metformin og glyburid er beskrevet i ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER, henholdsvis. Som med alle medicin skal effektivitetsresultater overvejes sammen med sikkerhedsoplysninger for at vurdere den potentielle fordel og risiko for en individuel patient.
Kombination med Metformin eller Sulfonylurea
Tilsætningen af AVANDIA til enten metformin eller sulfonylurinstof resulterede i signifikante reduktioner i hyperglykæmi sammenlignet med et af disse midler alene. Disse resultater er i overensstemmelse med en additiv effekt på glykæmisk kontrol, når AVANDIA anvendes som kombinationsterapi.
Kombination med Metformin
I alt 670 patienter med type 2-diabetes deltog i to 26-ugers, randomiseret, dobbeltblind, placebo / aktiv-kontrollerede studier designet til at vurdere effektiviteten af AVANDIA i kombination med metformin. AVANDIA, indgivet i en gang dagligt eller to gange dagligt doseringsregimer, blev føjet til behandlingen af patienter, der blev utilstrækkeligt kontrolleret med en maksimal dosis (2,5 gram / dag) metformin.
I en undersøgelse kontrollerede patienter utilstrækkeligt 2,5 gram / dag metformin (gennemsnit FPG 216 mg / dL og gennemsnitlig basislinje HbA1c 8,8%) blev randomiseret til at modtage 4 mg AVANDIA en gang dagligt, 8 mg AVANDIA en gang dagligt eller placebo foruden metformin. En statistisk signifikant forbedring af FPG og HbA1c blev observeret hos patienter behandlet med kombinationerne af metformin og 4 mg AVANDIA en gang dagligt og 8 mg AVANDIA en gang dagligt, sammenlignet med patienter fortsatte med metformin alene (Tabel 10).
Tabel 10 Glykæmiske parametre i en 26-ugers kombinationsundersøgelse af AVANDIA Plus Metformin
| Metformin N = 113 |
AVANDIA 4 mg en gang dagligt + metformin N = 116 |
AVANDIA 8 mg en gang dagligt + metformin N = 110 |
|
| FPG (mg / dL) | |||
| Baseline (gennemsnit) | 214 | 215 | 220 |
| Skift fra basislinje (gennemsnit) | 6 | -33 | -48 |
| Forskel fra metformin alene (justeret gennemsnit) | - | -40* | -53* |
| % af patienterne med 30 mg / dL ¥ faldt fra baseline | 20% | 45% | 61% |
| HbA1c (%) | |||
| Baseline (gennemsnit) | 8.6 | 8.9 | 8.9 |
| Skift fra basislinje (gennemsnit) | 0.5 | -0.6 | -0.8 |
| Forskel fra metformin alene (justeret gennemsnit) | - | -1.0* | -1.2* |
| % af patienter med â € 0,7% falder fra baseline | 11% | 45% | 52% |
| * p <0,0001 sammenlignet med metformin. |
I en anden 26-ugers undersøgelse kontrollerede patienter med type 2-diabetes utilstrækkeligt 2,5 gram / dag metformin, som blev randomiseret til at modtage kombinationen af AVANDIA 4 mg to gange dagligt og metformin (N = 105) viste en statistisk signifikant forbedring i glykæmisk kontrol med en gennemsnitlig behandlingseffekt for FPG på -56 mg / dL og en gennemsnitlig behandlingseffekt for HbA1c på -0,8% over metformin alene. Kombinationen af metformin og AVANDIA resulterede i lavere niveauer af FPG og HbA1c end begge midler alene.
Patienter, der var utilstrækkeligt kontrolleret med en maksimal dosis (2,5 gram / dag) metformin, og som var skiftet til monoterapi med AVANDIA påviste tab af glykæmisk kontrol, hvilket fremgår af stigninger i FPG og HbA1c. I denne gruppe blev der også set stigninger i LDL og VLDL.
Kombination med en sulfonylurinstof
I alt 3.457 patienter med type 2-diabetes deltog i ti 24- til 26-ugers randomiserede, dobbeltblinde, placebo / aktiv-kontrollerede studier og en 2-årigt dobbeltblindt, aktivt kontrolleret studie hos ældre patienter designet til at vurdere effektiviteten og sikkerheden ved AVANDIA i kombination med en sulfonylurinstof. AVANDIA 2 mg, 4 mg eller 8 mg dagligt blev administreret, enten en gang dagligt (3 undersøgelser) eller i opdelte doser to gange dagligt (7 undersøgelser) til patienter, der er utilstrækkeligt kontrolleret med en submaximal eller maksimal dosis på sulfonylurinstof.
I disse undersøgelser blev kombinationen af AVANDIA 4 mg eller 8 mg dagligt (indgivet som opdelte doser enkeltvis eller to gange dagligt) og en sulfonylurinstof reducerede signifikant FPG og HbA1c sammenlignet med placebo plus sulfonylurinstof eller yderligere op-titrering af sulfonylurinstof. Tabel 11 viser samlede data for 8 undersøgelser, hvor AVANDIA tilsat til sulfonylurinstof blev sammenlignet med placebo plus sulfonylurinstof.
Tabel 11. Glykæmiske parametre i 24- til 26-ugers kombinationsundersøgelser af AVANDIA Plus Sulfonylurea
| To dagligt delt dosering (5 studier) | sulfonylurinstof N = 397 |
AVANDIA 2 mg to gange dagligt + sulfonylurinstof N = 497 |
sulfonylurinstof N = 248 |
AVANDIA 4 mg to gange dagligt + sulfonylurinstof N = 346 |
| FPG (mg / dL) | ||||
| Baseline (gennemsnit) | 204 | 198 | 188 | 187 |
| Skift fra basislinje (gennemsnit) | 11 | -29 | 8 | -43 |
| Forskel fra sulfonylurinstof alene (justeret gennemsnit) | - | -42* | - | -53* |
| % af patienterne med 30 mg / dL ¥ faldt fra baseline | 17% | 49% | 15% | 61% |
| HbA1c (%) | ||||
| Baseline (gennemsnit) | 9.4 | 9.5 | 9.3 | 9.6 |
| Skift fra basislinje (gennemsnit) | 0.2 | -1.0 | 0.0 | -1.6 |
| Forskel fra sulfonylurinstof alene (justeret gennemsnit) | - | -1.1* | - | -1.4* |
| % af patienter med â € 0,7% falder fra baseline | 21% | 60% | 23% | 75% |
| Dosering én gang dagligt (3 undersøgelser) | sulfonylurinstof N = 172 |
AVANDIA 4 mg en gang dagligt + sulfonylurinstof N = 172 |
sulfonylurinstof N = 173 |
AVANDIA 8 mg en gang dagligt + sulfonylurinstof N = 176 |
| FPG (mg / dL) | ||||
| Baseline (gennemsnit) | 198 | 206 | 188 | 192 |
| Skift fra basislinje (gennemsnit) | 17 | -25 | 17 | -43 |
| Forskel fra sulfonylurinstof alene (justeret gennemsnit) | - | -47* | - | -66* |
| % af patienterne med 30 mg / dL ¥ faldt fra baseline | 17% | 48% | 19% | 55% |
| HbA1c (%) | ||||
| Baseline (gennemsnit) | 8.6 | 8.8 | 8.9 | 8.9 |
| Skift fra basislinje (gennemsnit) | 0.4 | -0.5 | 0.1 | -1.2 |
| Forskel fra sulfonylurinstof alene (justeret gennemsnit) | - | -0.9* | - | -1.4* |
| % af patienter med â € 0,7% falder fra baseline | 11% | 36% | 20% | 68% |
| * p <0,0001 sammenlignet med sulfonylurinstof alene. |
En af de 24 til 26 ugers undersøgelser inkluderede patienter, der var utilstrækkeligt kontrolleret med maksimale doser af glyburid og skiftede til 4 mg AVANDIA dagligt som monoterapi; i denne gruppe blev tab af glykæmisk kontrol påvist, hvilket fremgår af stigninger i FPG og HbA1c.
I en 2-årig dobbeltblind undersøgelse blev ældre patienter (i alderen 59 til 89 år) på halvmaksimum sulfonylurinstof (glipizid 10 mg to gange dagligt) randomiseret til tilsætning af AVANDIA (n = 115, 4 mg en gang dagligt til 8 mg efter behov) eller til fortsat op-titrering af glipizid (n = 110), til et maksimum på 20 mg to gange daglige. Den gennemsnitlige basislinje FPG og HbA1c var henholdsvis 157 mg / dL og 7,72% for AVANDIA plus glipizid-armen og henholdsvis 159 mg / dL og 7,65% for glipizid-op-titreringsarmen. Tab af glykæmisk kontrol (FPG â € 180 mg / dL) forekom hos en markant lavere andel af patienterne (2%) på AVANDIA plus glipizid sammenlignet med patienter i glipizid-op-titreringsarmen (28,7%). Cirka 78% af patienterne i kombinationsterapi afsluttede de 2 år med terapi, mens kun 51% afsluttede monoterapi med glipizid. Virkningen af kombinationsterapi på FPG og HbA1c var holdbar i den 2-årige studieperiode med patienter opnåelse af et gennemsnit på 132 mg / dL for FPG og et gennemsnit på 6,98% for HbA1c sammenlignet med ingen ændring på glipizid arm.
Kombination med Sulfonylurea Plus Metformin
I to 24- til 26-ugers, dobbeltblinde, placebokontrollerede studier designet til at vurdere effektiviteten og sikkerheden af AVANDIA i kombination med sulfonylurea plus metformin, AVANDIA 4 mg eller 8 mg dagligt, blev administreret i opdelte doser to gange dagligt til patienter, der var utilstrækkeligt kontrolleret med submaximal (10 mg) og maksimale (20 mg) doser af glyburid og maksimal dosis metformin (2 g / dag). En statistisk signifikant forbedring i FPG og HbA1c blev observeret hos patienter behandlet med kombinationerne af sulfonylurinstof plus metformin og 4 mg AVANDIA og 8 mg AVANDIA versus patienter fortsatte med sulfonylurinstof plus metformin, som vist i tabel 12.
Tabel 12. Glykæmiske parametre i en 26-ugers kombinationsundersøgelse af AVANDIA Plus Sulfonylurea og Metformin
| Sulfonylurea + metformin N = 273 |
AVANDIA 2 mg to gange dagligt + sulfonylurinstof + metformin N = 276 |
AVANDIA 4 mg to gange dagligt + sulfonylurinstof + metformin N = 277 |
|
| FPG (mg / dL) | |||
| Baseline (gennemsnit) | 189 | 190 | 192 |
| Skift fra basislinje (gennemsnit) | 14 | -19 | -40 |
| Forskel fra sulfonylurinstof plus metformin (justeret gennemsnit) | - | -30* | -52* |
| % af patienterne med 30 mg / dL ¥ faldt fra baseline | 16% | 46% | 62% |
| HbA1c (%) | |||
| Baseline (gennemsnit) | 8.7 | 8.6 | 8.7 |
| Skift fra basislinje (gennemsnit) | 0.2 | -0.4 | -0.9 |
| Forskel fra sulfonylurinstof plus metformin (justeret gennemsnit) | - | -0.6* | -1.1* |
| % af patienter med â € 0,7% falder fra baseline | 16% | 39% | 63% |
| * p <0,0001 sammenlignet med placebo. |
top
Referencer
- Food and Drug Administration Briefing Document. Fælles møde i Endocrino Metabolic Drugs and Drug Safety and Risk Management Advisory Committee. Juli 2007.
- DREAM prøveundersøgere. Virkning af rosiglitazon på hyppigheden af diabetes hos nedsat glukosetolerance eller nedsat fastende glukose: en randomiseret kontrol Lancet 2006;368:1096-1105.
- Home PD, Pocock SJ, Beck-Nielsen H, et al. Rosiglitazone evalueres for cardiovas-resultater - en interimsanalyse. NEJM 2007; 357: 1-11.
- Park JY, Kim KA, Kang MH, et al. Effekt af rifampin på farmakokinetikken af rosiglitazon hos raske individer. Clin Pharmacol Ther 2004; 75: 157-162.
top
Hvordan leveres / opbevaring og håndtering
Hver femkantede filmovertrukne TILTAB-tablet indeholder rosiglitazon som maleat som følger: 2 mg-pink, præget med SB på den ene side og 2 på den anden; 4 mg-orange, præget med SB på den ene side og 4 på den anden; 8 mg-rødbrun, præget med SB på den ene side og 8 på den anden.
- 2 mg flasker på 60: NDC 0029-3158-18
- 4 mg flasker med 30: NDC 0029-3159-13
- 4 mg flasker på 90: NDC 0029-3159-00
- 8 mg flasker med 30: NDC 0029-3160-13
- 8 mg flasker med 90: NDC 0029-3160-59
Opbevares ved 25 ° C; udflugter 15 til 30 C (59 til 86 F). Dispenser i en tæt, letbestandig beholder.
sidst opdateret 02/2008
Avandia, rosiglitazonmaleat, patientinformation (på almindeligt engelsk)
Detaljeret information om tegn, symptomer, årsager, behandling af diabetes
Oplysningerne i denne monografi er ikke beregnet til at dække alle mulige anvendelser, retninger, forholdsregler, medikamentinteraktion eller ugunstige virkninger. Denne information er generaliseret og er ikke beregnet til specifik medicinsk rådgivning. Hvis du har spørgsmål til de medicin, du tager eller ønsker flere oplysninger, skal du kontakte din læge, apotek eller sygeplejerske.
tilbage til:Gennemse alle medicin mod diabetes



